研究に関すること

研究に関すること

研究内容
私達は以下の5つのテーマを主に行っています
(ここに書いていないテーマもいっぱいやっています)
Research
01幹細胞の細胞周期制御メカニズム:全身の幹細胞の可視化に向けて
私たちの身体は、さまざまな構造・機能を持つ臓器(≒器官・組織)から構成されています。それぞれの組織において、すべての細胞を生み出すもとになっている細胞のことを「組織幹細胞」といいます。組織幹細胞は、組織全体のわずか0.001%という大変まれな細胞集団でありながら、数十年にも及ぶ寿命を持ち、特定の組織を一生涯にわたって維持する能力を有しています。
それぞれの組織ごとに特有の幹細胞が存在すると考えられていますが、多くの組織において、その正体はほとんど明らかにされていません。その理由としては、幹細胞の数がきわめて少ないことに加え、そもそも何を手掛かりにして幹細胞を探せばよいのか、いわば「組織幹細胞の目印」は何かということがほとんどわかっていないことが最大の要因といえます。
私たちは、組織幹細胞の大きな特徴である「静止状態(G0期)」に着目して研究を行ってきました。細胞が増殖するときには「細胞周期」にしたがって分裂を行うことで子孫の細胞を生み出していくことがよく知られていますが、組織幹細胞は長期にわたって細胞周期を停止し、あたかも冬眠しているような状態にあることがわかってきたのです。この静止状態にとどまることで、組織幹細胞は分裂に伴うストレスや老化を回避し、その性質を一生涯にわたって維持できると考えられます。
私たちはこれまでの研究において、静止状態の維持に重要な因子である「p57」という遺伝子が、血液・神経・腸管の幹細胞で非常に高レベルに発現していることを見出してきました。さらにノックアウトマウスを用いた実験から、p57は組織幹細胞を静止状態にとどめておくことで、幹細胞の維持に必須の役割を果たしていることを明らかにし、これらの発見は世界的にも高い評価を受けています。
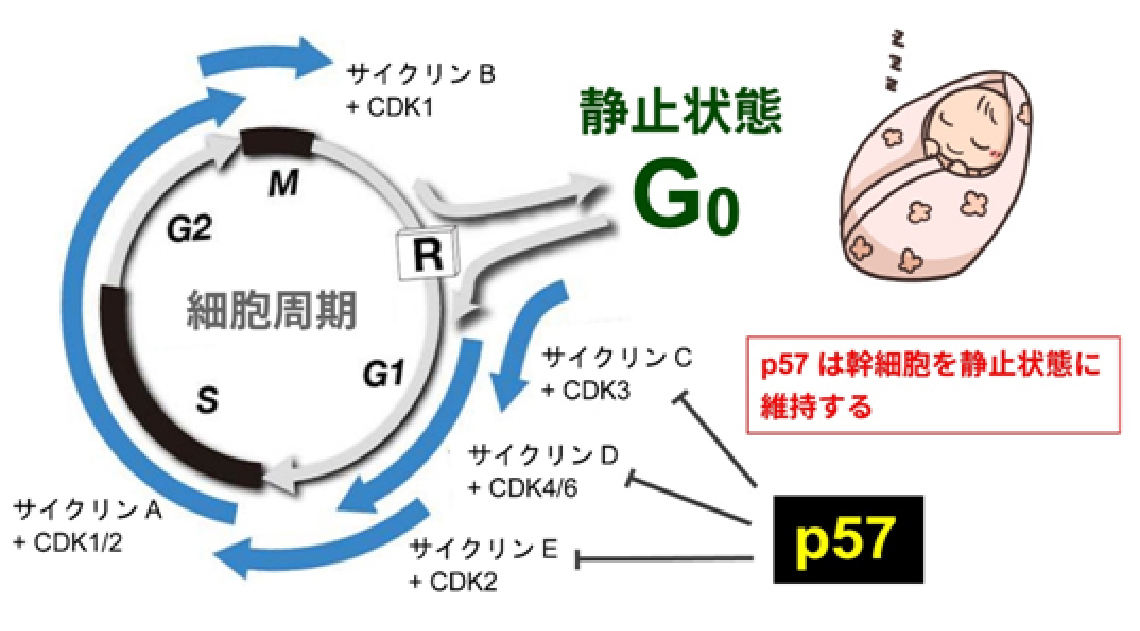
ここで大変興味深いのは、このp57は「幹細胞だけ」に発現し、他の細胞にはまったく発現していないという点です。さらに、その発現パターンと機能的な重要性は、血液・神経・腸管という最も研究が進んでいる3種類の組織幹細胞において共通しています。
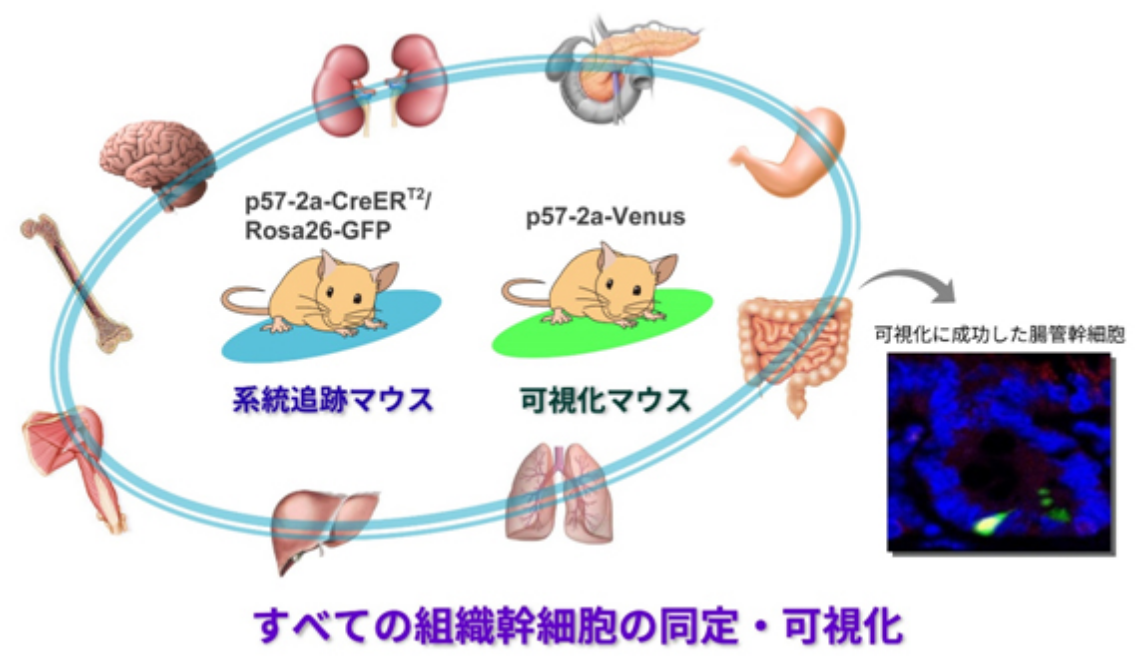
この事実はすなわち、「p57を目印として用いれば、すべての組織において幹細胞を探し出すことができるのではないか」という可能性を強く示唆しています。最近、私たちはこの仮説に基づいて、以下の2種類の遺伝子改変マウスの作出に成功しました。
近い将来、これら2つのシステムを組み合わせることで、各組織の幹細胞の性質や挙動を生体内(in vivo)で理解することができるようになると考えています。
近年、iPS細胞の登場によって再生医療への道が開かれましたが、そもそも生体内に存在する組織幹細胞がよくわかっていないという事実は、その現実化を進めるうえで大きな障壁となっています。また、臨床医学最大のブラックボックスであるがんや老化といった現象も組織幹細胞の異常であることが予想されていますが、やはりその仕組みを解明するにはまず正常の幹細胞について詳細に理解することが不可欠です。現在の私たちの研究は、これらの問題を解決する糸口となると考えています。
Research
02がん幹細胞の根絶:がんの治療を180度転換する
65才以上の方の割合がまもなく3割に到達しようとしている今の日本で、ダントツの死因は何かお分かりですか?それは「がん」であり、日本人の2人に1人はがんに罹り、3人に1人はがんで死ぬ時代です。しかもがんの発症率は年齢の5乗に比例すると言われているので、高齢化が進めば今後ますますがんの患者さんが増えていくでしょう。若いみなさんも他人事でありませんね。
がんは細胞が勝手にどんどん増殖してしまう病気ですが、正常細胞を攻撃せずに、異常ながん細胞だけを狙い撃ちして治療することは現在もほとんど成功していません。現在の抗がん剤のほとんどは、増殖が速い細胞を殺す薬剤ですが、がん細胞にも増殖が遅い細胞がごく一部含まれていて、その細胞こそががんの親玉 (がん幹細胞) であることが近年わかってきました。つまり抗がん剤だけでは増殖の遅いがんの親玉は退治できず、これが再発の原因になるのです。これを専門用語を使ってまとめると、がん幹細胞が細胞増殖期から外れた静止期 (G0期) にいることで、がんの治療抵抗性が生じているということになります。
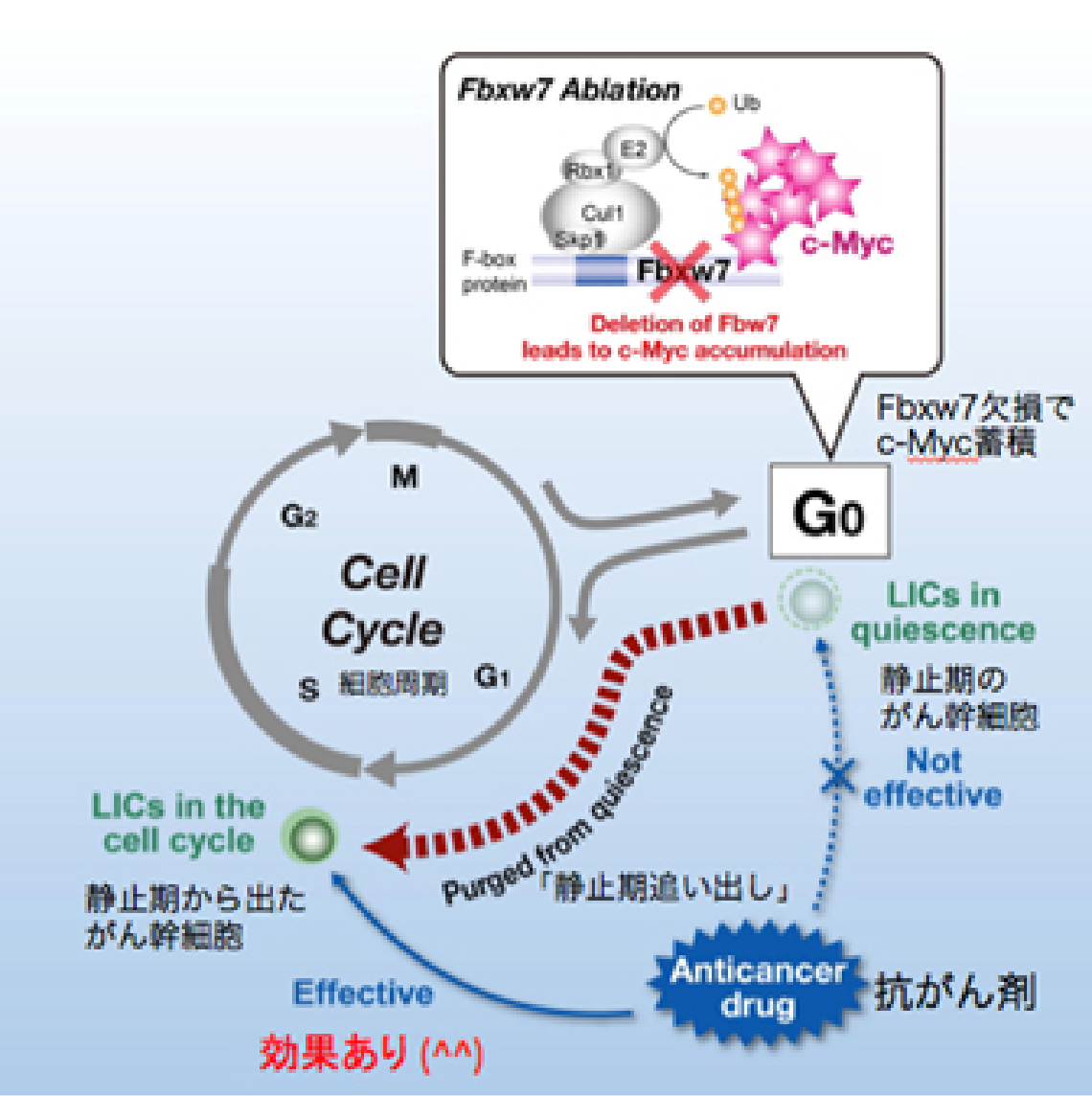
私たちは長年にわたって細胞増殖とユビキチン (不要になったタンパクにつけられる目印) を研究してきたので、その成果ががんの親玉退治に応用できないのかと思い、血液のがんの一種である慢性骨髄性白血病を題材に調べてみました。すると興味深いことに、がん幹細胞でFbxw7というユビキチンをつける酵素が高発現していることが分かりました。
私たちはこの酵素がc-Mycを分解することを世界に先駆けて報告しました。c-Mycは細胞増殖のアクセル分子であるため、もしがん幹細胞のFbxw7を壊せばc-Mycが蓄積し、細胞増殖のアクセルが踏まれるはずです。その結果、がん幹細胞が静止期から細胞増殖期へと追い出され、抗がん剤で殺せるのではないかと考えました。つまりFbxw7を壊してがん幹細胞を細胞増殖期へと移行させれば、従来の抗がん剤でがん幹細胞をやっつけることができるようになるだろうという仮説を立てるに至りました (図2-1) 。
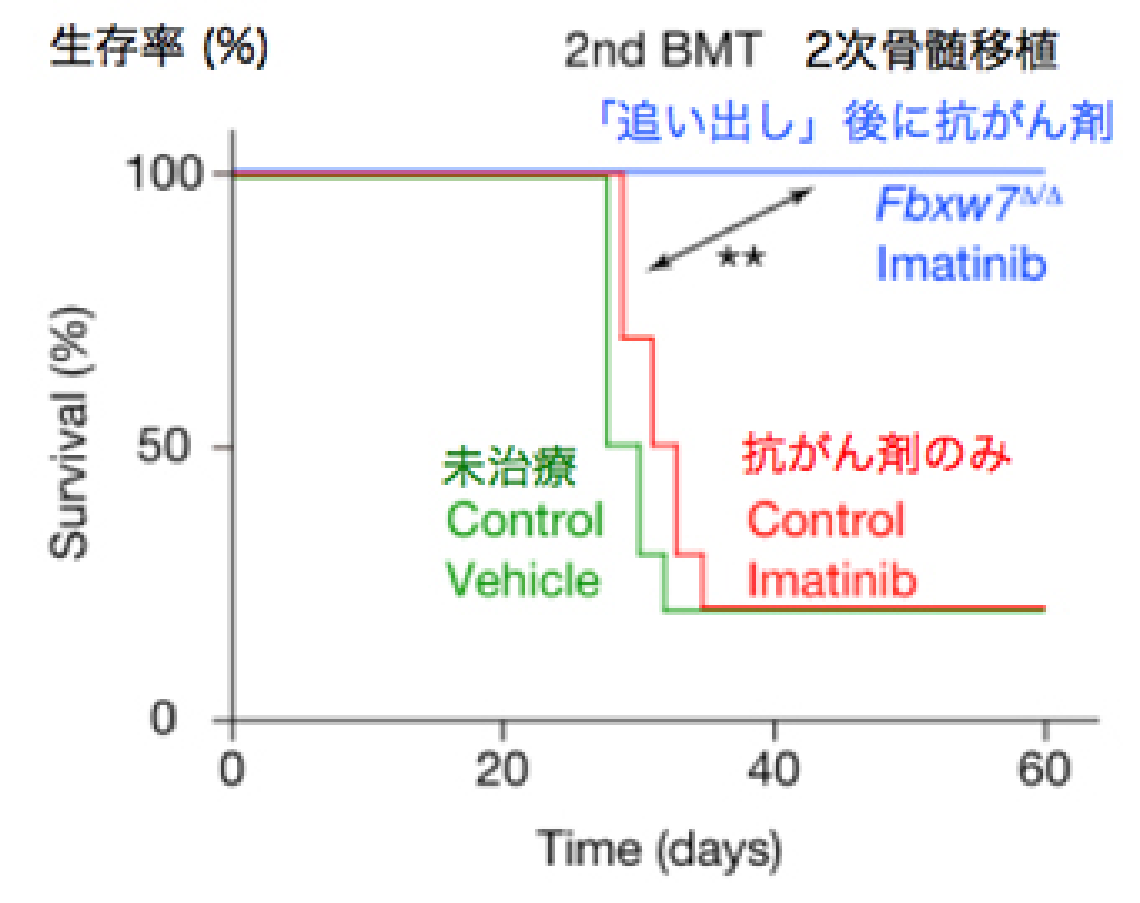
この仮説を元に、実際に実験を行ったところ、Fbxw7を欠損したがん幹細胞では予想通り静止期の割合が減少していることが判明し、さらに驚くべきことに抗がん剤治療後の生存率も著明に改善することが明らかとなりました (図2-2) 。
このようにして、動物モデルではFbxw7を抑制することによってがん幹細胞を根絶することに成功しましたが、いち早くヒトに対して応用するためには薬剤の開発が欠かせません。現在はFbxw7の阻害剤の開発を急ぐと同時に、他のがんでも効果があるかどうか、逆に静止期のままずっと眠らせておくことは可能なのかということも研究しています。
Research
03がん転移メカニズムの解明:実際にヒトを治療する試み
現在、日本人の2人に1人はがんにかかるといわれています。しかしがんは、なってしまえば必ず死ぬというわけではなく、外科手術や化学療法等をおこなえばある程度は治るようになってきました。一方、がんがいったん転移をしてしまえば、生存の確率は格段に低くなります。がん転移は複数の部位にわたることが多く外科手術が困難な上、既に化学療法等に耐えたがん細胞が増殖するため、これまでの治療法が効かなくなることが多いからです。このため、従来の「がん細胞を殺す」治療戦略に加え、「がん転移を抑制する」戦略が考えられ始めています。
がん細胞が生存・転移するためには、がん細胞自身の能力に加え、がん細胞の周りの正常細胞(がんニッチ細胞)の手助けが必要であることがわかってきました。がん細胞は自身の成長に有利な「お助け細胞」を呼び寄せたり、周りにいる正常細胞を“教育”して「お助け細胞」に変えてしまいます。また自分の周りだけではなく、これから転移する行先さえも居心地がいいように遠隔操作してしまいます。逆に言えば、これらのがんニッチ細胞からの手助けを断ち切ってしまえば、がん細胞は増殖や転移をしにくくなると考えられます。
われわれは最近がんニッチ細胞中のFbxw7というタンパク質ががん抑制機能、とりわけがん転移を抑制する機能を持っていることを見出しました。Fbxw7が体質的に低い人は高い人に比べてがんが再発しやすく、実験的にがんニッチ細胞でFbxw7を欠損させると「がん転移お助け細胞」になることがわかりました。この「Fbxw7欠損お助け細胞」はCCL2と呼ばれるサイトカイン*1を多く分泌してがん細胞の転移を促進していました。われわれはCCL2の機能を抑制すればがん転移は抑制できると考え、「プロパゲルマニウム」というCCL2機能抑制をもつ薬を用いたところ、マウスの系でがん転移を強力に抑制することがわかりました。
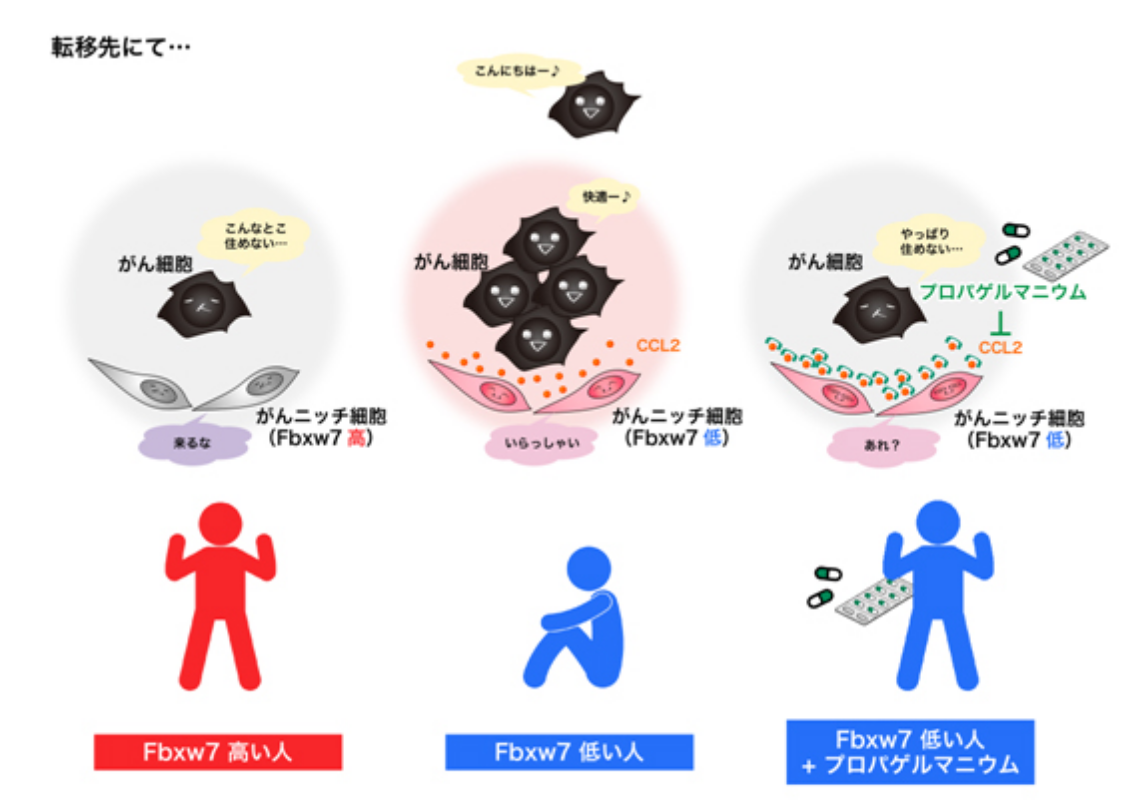
プロパゲルマニウムはB型肝炎治療薬として20年近く使用されてきた既存薬であり、ドラックリポジショニング*2の好例となることが期待されます。本薬は、既に様々な施設との共同研究により各種がん患者に対して治験を始めており、同時に、どのようながんにどのように効くか、さらなる検証実験を進めています。本研究により「がん」が「死なない病気」になることを期待しています。
*1 サイトカイン:細胞から放出され、様々な細胞間相互作用を媒介するタンパク質(液性因子)の総称
*2 ドラックリポジショニング:ある疾患に有効な治療薬から、別の疾患に有効な新たな薬効を見つけ出すこと
Research
04自閉症研究:コミュニケーションを科学する
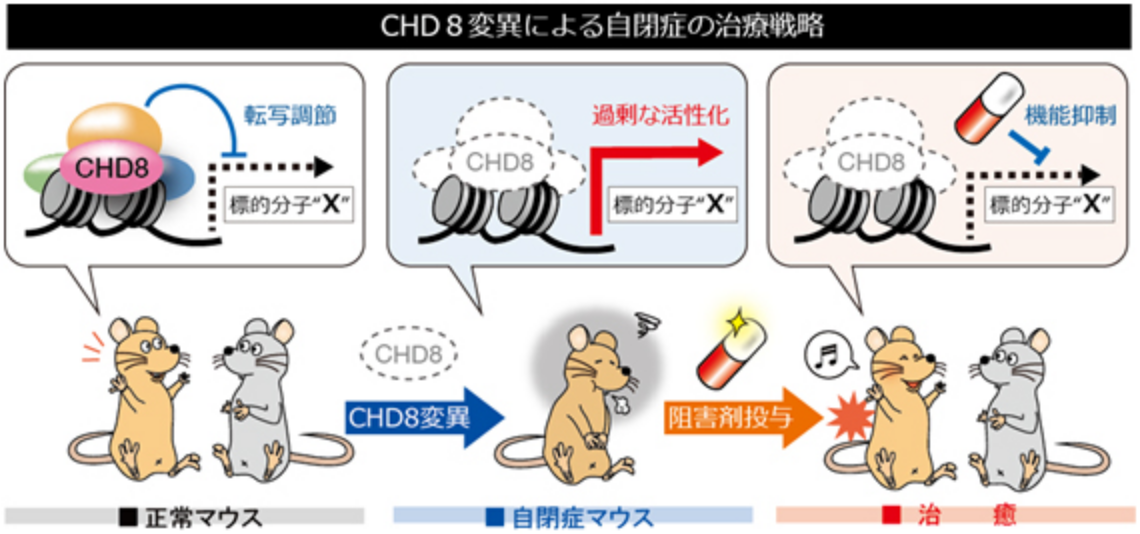
みなさんの周りにちょっと変わった人、不思議ちゃん、KYなどと呼ばれている人がいませんか?そのような人たちの中に、自閉症スペクトラムと呼ばれる先天性のコミュニケーション障害を抱えている人がいることをご存知でしょうか。自閉症は、全人口の約2%が罹患する非常に頻度の高い疾患であり、医学的のみならず社会的に大きな問題となっています。自閉症の本質はコミュニケーション障害および常同・反復的な興味・行動を示す発達障害であり、その発症メカニズムの解明と治療法の開発が強く求められています。
自閉症は親の育て方が悪いなどの環境要因が原因だと思っている人がいるかもしれません。しかし、実際には自閉症の発症には遺伝的要因が強く関わっていることが分かっています。例えば、同じゲノムを持つ一卵性双生児では自閉症発症の一致率が90%程度である一方で、二卵性双生児では一致率が数%程度であることが報告されています。近年、自閉症患者の大規模なゲノム解析によって、私たちのグループが今まで長年にわたって研究してきた「CHD8」という遺伝子が最も有力な自閉症原因候補遺伝子として同定され、世界中で大きな反響を呼んでいます。

CHD8はATP依存性クロマチンリモデリング因子のSNF2スーパーファミリーに属し、クロマチン構造を変化させることによって転写を調節する分子であると考えられています。CHD8(Duplin)はもともとWnt–βカテニンシグナル伝達経路の負の制御因子として同定されましたが、私たちは世界で初めてCHD8ノックアウトマウスを作製し、これらのマウスが発生初期にアポトーシスの異常な亢進により死亡することを見出しました。さらにこれまでにCHD8がp53やβカテニンの転写活性を抑制することで発生期の器官形成に重要な役割を果たしていることを示してきました。
最近、ヒト自閉症患者で報告されたCHD8変異を再現したマウスを作製し行動解析を行ったところ、自閉症を特徴付ける行動異常である社会的行動の異常や不安様行動の増加が観察されました。さらに遺伝子発現解析によって神経発生の重要な制御因子が異常活性化しており、ヒトでの知見と同様に神経発生遅延が起こることを実証しました。私たちは、これまでに作製した種々のCHD8機能喪失型マウス(ノックアウトマウス)とCHD8機能獲得型マウス(トランスジェニックマウス)を組み合わせることによって自閉症の発症時期、責任部位、責任細胞種を特定すると共に、自閉症の発症メカニズムを解明し、これらのモデルマウスを用いて新しい疾患治療法の確立を目指しています。
Research
05プロテオーム研究:生命の設計図を描く
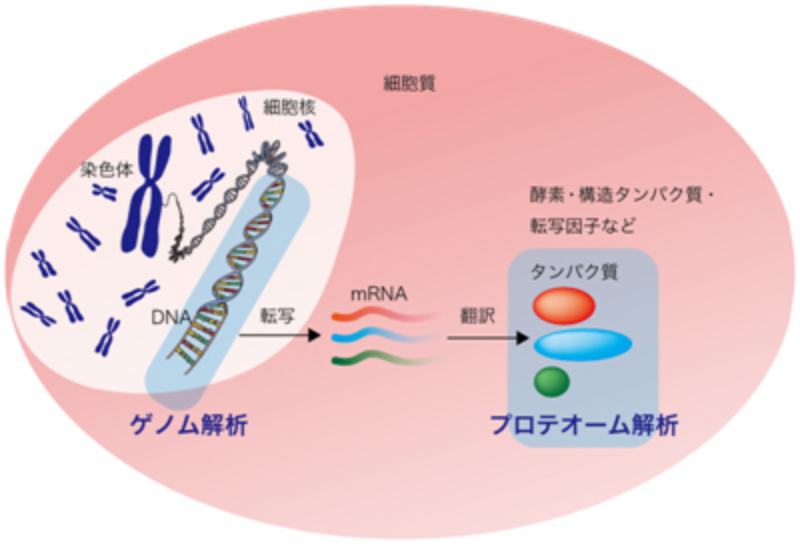
われわれが代々受け継いできた遺伝情報(その全体をゲノムと呼ぶ)は染色体上に四種類の塩基(AGCT)の配列としてコードされています。ゲノム配列情報の解析は生命の設計図を得ることに等しいと考えられ、世界中でゲノム解読プロジェクトが進行し、2000年代前半にはヒトや主要なモデル生物種のゲノム配列の解読が完了しました。しかしながら、解読されたゲノム配列は生命を構成する部品リストであり、生命の設計図とは程遠いものでした。
生命を理解するためにはこれらの部品がどのように組み合わさり、システムを構成しているかを知る必要があります。ほとんどの遺伝子は転写、翻訳されてタンパク質となりその機能を発揮します。つまりゲノムはプロテオーム(ゲノムから発現するタンパク質の総体)に変換され細胞システムを構築しているわけです。個々の細胞において各々の遺伝子は常に一定であるのに対して、タンパク質は極めて広い存在量幅(ヒトの細胞では10の6乗以上と言われている)を持っており、その状態は状況に応じて刻一刻と変わります。したがって、生命の設計図を描くには、タンパク質の発現量や機能を定量的に計測し、プロテオームが織りなす分子ネットワークの構造や機能を知ることが重要です。
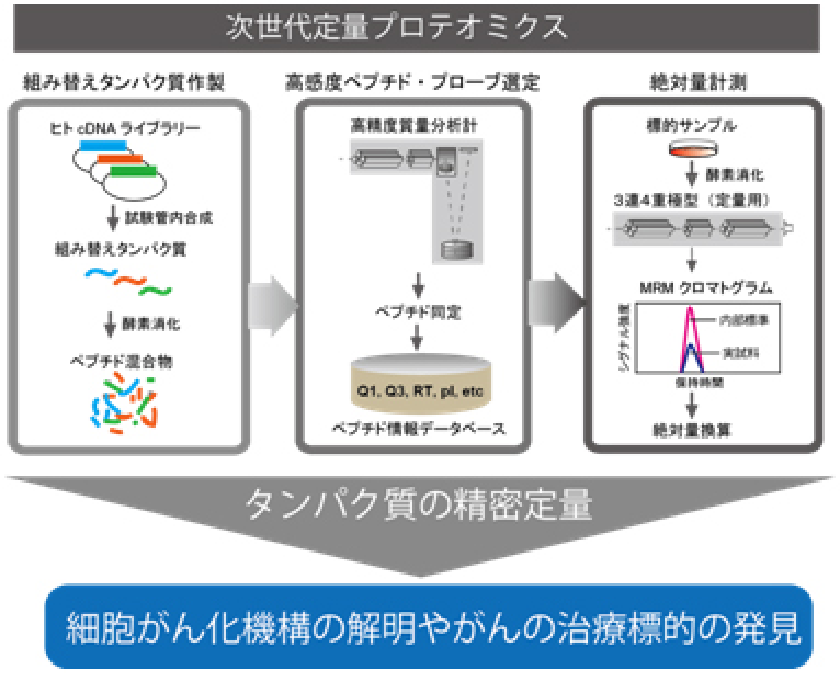
プロテオームを研究する学問領域である”プロテオミクス”では、主に質量分析計と呼ばれる機器を用います。私たちの研究室では15台の質量分析計を駆使してプロテオミクスに関する技術開発を行ってきました。

最近では、次世代の定量プロテオーム解析技術iMPAQT (in vitro proteome–assisted MRM for protein absolute quantification)法を開発し(日米英で特許取得済み)、様々な生物学や医学の研究に利用しています。
iMPAQT法では網羅的な組み替えタンパク質ライブラリーを利用して定量プロテオミクスの手法であるMRM(multiple reaction monitoring)を大規模に実施し、正確なタンパク質の絶対量を計測することが可能です。また、タンパク質の機能制御に重要なリン酸化やユビキチン化などの翻訳後修飾羅的に解析する技術も確立しており、これらを統合的に用いれば細胞の状態を規定するタンパク質情報を多面的かつ定量的に得ることが可能です。得られたタンパク質精密計測データを数理・統計学的手法で解析し、細胞システムの動作原理の解明に挑んでいます。例えば、細胞がん化やがん悪性進展過程のプロテオーム解析から、がん細胞に特有な分子ネットワークの同定を行い、これらを対象とした新たながん治療戦略の確立を目指しています。

研究の軌跡
※ 中山が最終著者またはコレスポ
※ 主要な共同研究
1996
p27ノックアウトマウスを作製し、世界で初めてCDKインヒビターの欠損によってがんが生じることを発見した ( Nakayama et al., Cell, 表紙 )
1997
Bcl-2ノックアウトマウスの骨髄移植実験によって、Bcl-2が骨髄幹細胞の生存に重要であることを証明した ( Matsuzaki et al., Blood )
1998
Bcl-2のファミリー分子であるA1のノックアウトマウスを作製し、好中球でのアポトーシスが亢進していることを発見した ( Hamasaki et al., J. Exp. Med. )
1999
F-boxタンパク質FWD1(β-TrCP1/Fbxw1)がβカテニンやIκBを認識することを発見した ( Hatakeyama et al., Proc. Natl. Acad. Sci. USA; Kitagawa et al., EMBO J. )
FWD1と基質の結合様式や他のIκBファミリーに対する反応性などを明らかにした ( Shirane et al., J. Biol. Chem.; Hattori et al., J. Biol. Chem. )
p27のユビキチン化に関する詳細な生化学的解析を行った ( Shirane et al., J. Biol. Chem. )
2000
世界で初めてのF-boxタンパク質ノックアウトマウスであるSkp2ノックアウトマウスを作製し、p27やサイクリンEが高度に蓄積していることを発見した ( Nakayama et al., EMBO J. )
チェックポイントに関わる分子であるChk1のノックアウトマウスを作製し、Chk1が発生段階のDNA傷害チェックポイントに重要であることを示した ( Takai et al., Genes Dev. )
サイトカインレセプターに会合するチロシンキナーゼTyk2のノックアウトマウスを作製し、インターフェロンαに対する応答性やIL-12を介するレスポンスが障害されていることを発見した ( Shimoda et al., Immunity )
IκBキナーゼキナーゼとしてNAKを発見 ( Tojima et al., Nature )
p27の主要リン酸化部位がSer-10であることを発見 ( Ishida et al., J. Biol. Chem. )
サイクリンのユビキチン化に関わるE2の一つであるmE2-CがAPC/Cによってユビキチン化されることを証明した ( Yamanaka et al., Mol. Biol. Cell )
p57ノックアウトマウスを作製し、ほとんどが出生付近で死亡することを発見。口蓋裂や骨格異常、さらに腸管の欠損等、p27ノックアウトマウスとは大きく異なることを示した ( Takahashi et al., J. Biochem. )
2001
Skp2ノックアウトマウスにおいてもp27のユビキチン化は起こりうることを実証した。未知の細胞質内酵素活性を検出 ( Hara et al., J. Biol. Chem. )
世界で初めてU-box型ユビキチンリガーゼを発見した ( Hatakeyama et al., J. Biol. Chem. )
p27のT187A変異ノックインマウスを作製し、p27がS期からG2期にかけて分解不全を起こすものの、細胞周期は全体として異常なく進行することを報告した ( Malek et al., Nature )
A1ノックアウトマウスを用いて、A1がマスト細胞の生存に必須であることを証明した ( Xiang et al., J. Exp. Med. )
2002
PKCδのノックアウトマウスを作製し、B細胞の増殖が亢進して自己免疫疾患を発症することを発見した ( Miyamoto et al., Nature )
線虫におけるSkp1ホモログについて、多くのファミリーを同定し、その機能をRNAiで調べた ( Yamanaka et al., Curr. Biol. )
Skp2ノックアウトマウスの肝臓を部分切除すると、肝臓の組織容量は回復するが細胞数は増えていないことを発見した ( Minamishima et al., Cancer Res. )
p130ノックアウトマウスを作製し、p130がGABAAレセプターの機能に重要な役割を果たしていることを発見した ( Kanematsu et al., EMBO J. )
p27の主要リン酸化部位Ser-10のリン酸化はp27の核外移行を促進することを発見した ( Ishida et al., J. Biol. Chem. )
CHIPがParkinと会合してE4様の働きをしていることを実証した ( Imai et al., Mol. Cell )
2003
膜結合型イムノフィリンFKBP38がBcl-2やカルシニューリンに結合して、その活性を制御することにより、抗アポトーシス作用を有することを発見した ( Shirane & Nakayama, Nature Cell Biol. )
FWD1(β-TrCP1/Fbxw1)のノックアウトマウスを作製し、βカテニンやIβBの分解が部分的に阻害されていることを証明した ( Nakayama et al., Proc. Natl. Acad. Sci. USA )
p57のユビキチン化がSkp2によって行われていることを発見した ( Kamura et al., Proc. Natl. Acad. Sci. USA )
Skp2のプロモーターを解析し、RasからのシグナルによってGABPが結合して転写を活性化していることを証明した ( Imaki et al., Cancer Res. )
2004
原らが以前発見していたp27に対する未知の細胞質内酵素を精製し、クローニングした。これはKPC(Kip1 ubiquitylation Promoting Complex)と名付けられ、p27のG1期でのユビキチン化に関与していることを発見した ( Kamura et al., Nature Cell Biol. )
p27/Skp2ダブルノックアウトマウスを作製し、Skp2ノックアウトマウスでの異常がほとんど消失することにより、Skp2の主要な標的がp27であることを証明した ( Nakayama et al., Dev. Cell )
c-MycのユビキチンリガーゼがFbw7であることを発見した ( Yada et al., EMBO J. )
われわれが発見した高等生物で初めてのE4分子であるE4B/UFD2aが、ポリグルタミン病原因分子Ataxin-3/MJD1のユビキチン化に関わることを発見し、ショウジョウバエを用いた研究によって、その治療効果を実証した ( Matsumoto et al., EMBO J. )
Cul2とCul5に結合するBCボックスタンパク質を特定し、Cul2-Rbx1とCul5-Rbx2は異なるBCボックスタンパク質(VHLドメインとSOCSドメイン)を認識することを発見した ( Kamura et al., Genes Dev. )
Fbw7のノックアウトマウスを作製し、胎生期に血管分化異常を呈して死亡することを発見した ( Tsunematsu et al., J. Biol. Chem. )
Fbw7がp53依存性のハプロインサフィシエントな癌抑制遺伝子であることを発見した ( Mao et al., Nature )
Duplin/CHD8のノックアウトマウスを作製し、胎生期に強いアポトーシスを呈して死亡することを発見した ( Nishiyama et al., Mol. Cell. Biol. )
2005
p27ノックアウトマウスでは、膵島の肥大によって高血糖になりにくいことを証明した ( Uchida et al., Nature Med. )
p27のS10Aノックインマウスを作製し、G0期の安定性が極度に低くなっていることを発見した ( Kotake et al., J. Biol. Chem. )
c-Mycを分解する人工ユビキチンリガーゼMax-Uを作製し、それががん形質を抑制し、実際に治療効果があることを証明した ( Hatakeyama et al., Cancer Res. )
Skp2がRAG-2をユビキチン化し、VDJ再構成に関与していることを証明した ( Jiang et al., Mol. Cell )
ALDH2ノックアウトマウスを作製し、ALDH2がニトログリセリンによる血管拡張に重要な役割を果たしていることを証明した ( Chen et al., Proc. Natl. Acad. Sci. USA )
E4B/UFD2aのノックアウトマウスを作製し、E4Bが心臓発生に重要な役割を果たしていることを明らかにした。またヘテロマウスでは生後1年程度より脊髄小脳失調を示すことが明らかとなった ( Kaneko-Oshikawa et al., Mol. Cell. Biol. )
KPC2の分子解剖的な検討を行い、UBL-UBAタンパク質として特異な性質を有することを報告した ( Hara et al., Mol. Cell. Biol. )
2006
未知の膜タンパク質プロトルーディンがRab11-GDPに結合して、神経突起形成に重要な役割を果たしていることを明らかにした ( Shirane & Nakayama, Science )
細胞周期と発がんに関与するユビキチンリガーゼ群について、詳細なレビュー ( Nakayama & Nakayama, Nature Rev. Cancer )
PKCδを介したシグナル伝達系が活性酸素による細胞老化に深く関わっていることを証明した ( Takahashi et al., Nature Cell Biol. )
Fbxw8ノックアウトマウスを作製し、この機能未知なF-boxタンパク質がCul1とCul7を橋渡しするような新規複合体を形成すること、胎盤の正常な発生にとって重要であることを報告した ( Tsunematsu et al., Mol. Cell. Biol. )
2007
Fbw7のT細胞特異的なコンディショナルノックアウトマウスを作製し、T細胞の細胞周期停止にFbw7が必須であることを発見した。またこのマウスではリンパ腫の発生を高頻度に認め、Fbw7が癌抑制遺伝子であることを世界で初めてマウスモデルで実証した ( Onoyama et al., J. Exp. Med. )
p27の核外移行がサイクリンD2に依存していることを発見した ( Susaki et al., Mol. Cell. Biol. )
Foxo3aのノックアウトマウスでは骨髄幹細胞の機能が一部喪失することを発見した ( Miyamoto et al., Cell Stem Cell )
2008
Fbw7の骨髄特異的コンディショナルノックアウトマウスを作製し、骨髄幹細胞におけるG0期の減少と骨髄再建能の喪失、およびT細胞急性リンパ性白血病を発症することを発見した ( Matsuoka et al., Genes Dev. )
FKBP38ノックアウトマウスを作製し、神経細胞におけるアポトーシスが亢進していること、プロトルーディンのリン酸化が亢進していることを発見した ( Shirane et al., Genes Cells )
Wnt経路依存的なp27の分解は、Skp2に依存せず、Cul4経路によって起こることを発見した ( Miranda-Carboni et al., Genes Dev. )
統合失調症関連遺伝子FEZ1のノックアウトマウスを作製し、過行動やドーパミン作動性神経の過活動、精神興奮剤への過剰な反応等、統合失調症の症状の一部を再現することに成功した ( Sakae et al., Hum. Mol. Genet. )
2009
クロマチンリモデリング因子CHD8がp53に結合し、さらにヒストンH1をリクルートすることによって、初期胚においてp53によるアポトーシス誘導を抑制することを発見した ( Nishiyama et al., Nature Cell Biol. )
p57遺伝子にp27をノックインしたマウスを作製し、生体内における大部分のp57の機能はp27によって置き換えられることが可能であることを証明した ( Susaki et al., Proc. Natl. Acad. Sci. USA )
Skp2がAktによってリン酸化され、それがSCFユビキチンリガーゼ活性に重要であること、またリン酸化されたSkp2は細胞質へ局在するようになることを証明した ( Lin et al., Nature Cell Biol. )
Protrudinの結合タンパク質としてVAPを同定し、その結合がProtrudinの突起伸長作用に必要であることを示した ( Saita et al., J. Biol. Chem. )
Fbxo45はF-boxタンパク質の一つであるが、F-boxドメインの一塩基置換によりSCF複合体を形成することができず、その代わりにPAMに結合することによって、Fbxo45-PAMという新規のユビキチンリガーゼ複合体を形成することが明らかとなった。またFbxo45のノックアウトマウスを作製したところ、PAMノックアウトマウスとよく似た神経分化の異常が認められた ( Saiga et al., Mol. Cell. Biol. )
2010
Rb欠損マウスでは下垂体に腫瘍を発生するが、これはSkp2を欠損させると完全に抑制されることが明らかとなった ( Wang et al., Nature Genet. )
新規ヒストン脱メチル化酵素KDM7がヒストンH3のK9とK27の脱メチル化を媒介するデュアルデメチレースであることを示し、脳の発生に必須の役割を果たしていることを発見した ( Tsukada et al., Genes Dev. )
Skp2の欠損は、癌遺伝子によって誘導される細胞老化プログラムを促進するが、これは従来提唱されているようなp19ARF/p53経路に依存しないことを明らかにした。またSkp2の阻害薬はp19ARF/p53経路が機能しない癌において細胞老化を誘導し、癌の予後を改善されることを証明した ( Lin et al., Nature )
E4Bトランスジェニックマウスを作製したところ、視床下部の神経内に凝集体が生じ、神経変性が起こると共に、マウスが高度に肥満することが明らかとなった ( Susaki et al., J. Biol. Chem. )
RhoA遺伝子の転写調節にはMyc/Skp2/Miz1/p300複合体が関係しており、Skp2はユビキチンリガーゼ活性とは関係なく、これらの複合体形成に関与する。Skp2の過剰発現はRhoAの増加につながり、癌転移に促進的に働くことが明らかとなった ( Chan et al., Nature Cell Biol. )
2011
Fbw7の肝臓特異的なコンディショナルノックアウトマウスでは、短期間ではSREBPの蓄積と共に脂肪肝になり、長期間ではNotchの蓄積と共に胆道増生による過誤腫が発生することを発見した ( Onoyama et al., J. Clin. Invest. )
Fbw7がBcl-2ファミリー分子の一つMcl-1をユビキチン化することによってアポトーシスを制御していることを明らかにした ( Inuzuka et al., Nature )
RAPLの欠損がp27のSer10リン酸化を介する局在異常のためにリンパ球が異常増殖することを明らかにした ( Katagiri et al., Immunity )
E3/E4活性を有するUBE4BがMdm2によるp53の分解を促進することによってp53の機能を抑制していることを発見した ( Wu et al., Nature Med. )
Fbw7の脳特異的なコンディショナルノックアウトマウスは、生直後に吸乳障害によって死亡する。このとき脳の発生過程でNotchの分解異常による蓄積と脳形態の異常を認め、神経幹細胞増加やアストロサイトへの分化亢進が発見された ( Matsumoto et al., J. Biol. Chem. )
骨髄特異的p57コンディショナルノックアウトマウスを作製し、p57が骨髄幹細胞のG0期維持に必須の分子であることを示した。さらにp57が欠損すると骨髄幹細胞の幹細胞性が喪失することにより、幹細胞においてG0期維持が大変重要であることが遺伝学的に実証された( Matsumoto et al., Cell Stem Cell )
FBXL5ノックアウトマウスは胎生早期致死であるが、その主要基質であるIRP2をダブルノックアウトすると正常に生まれるようになる。さらに肝臓特異的FBXL5コンディショナルノックアウトマウスを作製すると脂肪肝が起こり、そこに高鉄含有食を与えるとマウスが死亡することが明らかとなった。このことはFBXL5-IRP2系が鉄代謝における重要な制御機構であることを遺伝学的に示している ( Moroishi et al., Cell Metab. )
神経特異的p57コンディショナルノックアウトマウスを作製したところ、全身ノックアウトマウスが生直後に死亡するのに対して、生後2~3週まで生存可能であった。しかしこのマウスは非閉塞性水頭症と小脳の形成異常を伴い、特にゴルジ細胞等のPax2陽性前駆細胞が消失していた。この異常はp53依存性のアポトーシスによって起こることが遺伝学的に証明された ( Matsumoto et al., Mol. Cell. Biol. )
胎児肝における造血幹細胞の幹細胞性はp27とp57に依存しており、それは細胞質に局在するp27/p57がHsc70を介してサイクリンD1を結合することによって、サイクリンD1の細胞質から核への移行を阻害していることに基づくことを明らかにした ( Zou et al., Cell Stem Cell )
Protrudinの結合分子をプロテオミクスを用いて探索し、モーター分子KIF5との会合を証明した。さらにProtrudinはRab11をはじめとする多くのCargo分子をKIF5に載せるアダプター分子としての役割を果たすことが実証された ( Matsuzaki et al., Mol. Biol. Cell )
2012
CHD8がβカテニンと結合し、さらにヒストンH1をリクルートすることによってクロマチン構造を変化させ、Wnt標的因子の転写を抑制することが明らかとなった ( Nishiyama et al., Mol. Cell. Biol. )
サイクリンD1のユビキチン化に関与すると報告されている4つのF-boxタンパク質(Fbxo4、Fbxw8、Skp2、Fbxo31)は全て遺伝学的に関与が確認できないことを明らかにした ( Kanie et al., Mol. Cell. Biol. )
ErbB依存的なAktのユビキチン化はSCF/Skp2ユビキチンリガーゼによって起こり、それはAktの膜局在および活性化に必要である。またSkp2のサイレンシングはHer2過剰発現腫瘍をハーセプチンに対する感受性を高めることを発見した ( Chan et al., Cell )
ディファレンシャルプロテオミクスを利用してF-boxタンパク質の基質を網羅的に探索する技術(DiPIUS)を開発した ( Yumimoto et al., J. Proteome Res. )
リジンのないユビキチンを使って、網羅的なユビキチン化タンパク質の同定法を開発し、約800のタンパク質の約1400のユビキチン化部位を決定した ( Oshikawa et al., J. Proteome Res. )
2013
マイトファジー時にFKBP38やBcl-2がミトコンドリアからERへと脱出することを発見した ( Saita et al., Nature Commun. )
慢性骨髄性白血病においてFbxw7が欠損すると白血病幹細胞が静止期から追い出されて細胞増殖サイクルに進行し、抗がん剤によって死滅することを発見した。これはがん患者においても「G0期追い出し療法」によって、がんが根治できる可能性を示唆する ( Takeishi et al., Cancer Cell )
慢性骨髄性白血病においてFbxw7が欠損すると白血病幹細胞中にc-Mycが蓄積し、p53依存的なアポトーシスを起こして白血病幹細胞が死滅することを発見した ( Reavie et al., Cancer Cell )
FBXL3はCryをユビキチン化して分解を誘導するが、その類似分子であるFBXL21は逆にCryのユビキチン化によってそれを安定化することがわかった。FBXL3ノックアウトマウスの体内時計の異常はFBXL3/FBXL21ダブルノックアウトマウスでは正常化される ( Hirano et al., Cell )
DiPIUS法を用いてFbxw7の基質であるOASISとBBF2H7を同定し、Fbxw7による制御が骨・軟骨分化にとって重要であることを証明した ( Yumimoto et al., J. Biol. Chem. )
Fbxl3は、通常のF-boxタンパク質と異なり、基質であるCry1が結合したときのみSCF複合体を構築できることを発見した ( Yumimoto et al., J. Biol. Chem. )
Skp2の欠失は、pRb/p53の二重変異マウスにおける下垂体や前立腺における腫瘍形成を抑制した ( Zhao et al., Cancer Cell )
2014
pRb変異マウスにおける下垂体腫瘍形成時に、Skp2の欠失はE2F1の作用を増殖からアポトーシスへと変化させる ( Lu et al., Nature Commun. )
T細胞特異的p57コンディショナルノックアウトマウスを作製し、p57がT細胞分化に必須であり、p53の活性とTCRからのシグナルのバランスにp57が重要な役割を果たしていることを示した。またp57とp53のダブル欠損では悪性リンパ腫が発症することを明らかにした ( Matsumoto et al., Blood )
Protrudinが他のHereditary Spastic Paraplagia (HSP) の原因遺伝子産物と結合し、チューブ状ERを形成するのに役立っていることを発見した。またヒトHSP患者で発見された変異は、ERADの障害によってERストレスを起こすことを証明した ( Hashimoto et al., J. Biol. Chem. )
FBXL5の安定性を制御するユビキチンリガーゼとしてHERC2を同定した。HERC2はFBXL5のbasal turnoverを制御しているが、鉄依存的分解には関係ないことがわかった ( Moroishi et al., J. Biol. Chem. )
Fbxw7が精子幹細胞の自己複製能に対して抑制的に働いていることを明らかにした ( Kanatsu-Shinohara et al., Proc. Natl. Acad. Sci. USA )
ユビキチンリガーゼMDM2がRNAヘリケースDDX24をユビキチン化することがわかったが、これは分解に寄与せず、pre-rRNA processingに関与していることを発見した ( Yamauchi et al., Mol. Cell. Biol. )
プロテオミクス解析によってFKBP38の生理的な結合分子としてANKMY2を同定し、ANKMY2がShhシグナル伝達に対して正の作用を持ち、FKBP38はANKMY2を上流から抑制することで負の作用を発揮することを発見した ( Saita et al., J. Biol. Chem. )
インスリンシグナルで起こる変化を多階層オミクスで解析し、鍵となる酵素のリン酸化について発見した ( Yugi et al., Cell Rep. )
2015
骨髄特異的Fbxw7ノックアウトマウスではがん転移が増大し、それはMSCでNotch経路が活性化してCCL2の転写量が増え、その結果として腫瘍随伴マクロファージが増えたためであることを発見した。またCCL2レセプター阻害薬プロパゲルマニウムががん転移を強力に抑制することを見出した ( Yumimoto et al., J. Clin. Invest. )
p57が胎児神経幹細胞において特異的に発現しており、その欠損は成人幹細胞の発生を妨げることを明らかにした ( Furutachi et al., Nature Neurosci. )
FBXL12はALDH3を標的としてユビキチン依存性分解を誘導し、それは胎盤の分化に必須の役割を果たすことを証明した ( Nishiyama et al., Stem Cells )
2016
CHD8はヒトの自閉症で最も変異の多い遺伝子である。マウスにおいて1ペアあるCHD8遺伝子のうち片方を欠損させたヘテロ欠損マウスを作製したところ、その変異マウスは自閉症様症状を呈することが明らかとなった。さらにトランスオミクス解析によって、変異マウスの脳内で神経分化のマスターレギュレーターRESTが異常に活性化している事実を突き止めた。このRESTの異常活性化が神経の発達遅延を引き起こし、自閉症が発症するというメカニズムが高いと考えられた ( Katayama et al., Nature )
2017
lncRNAからはタンパク質は翻訳されないと信じられてきたが、LINC00961から翻訳されるペプチドSPARはリソソームに局在してv-ATPase複合体と結合することによりアミノ酸に依存的なmTOR複合体1の活性化を抑制することを発見した ( Matsumoto et al., Nature )
全てのタンパク質を絶対定量する新技術iMPAQTを開発し、がんにおける全ての代謝酵素の測定からその特徴を発見した ( Matsumoto et al., Nature Methods )
細胞内鉄濃度を制御するユビキチンリガーゼFBXL5の神経特異的コンディショナルノックアウトマウスを作製したところ、神経細胞の過剰増殖が見られることが判明した ( Yamauchi et al., Mol. Cell. Biol. )
プロトルーディン遺伝子のマイクロエクソンのスプライス制御にSRRM4が関与していることを発見した ( Ohnishi et al., Sci. Rep. )
ロボット(LabDroid まほろ)を用いて実験を行い、それをクラウド化するというコンセプトを提唱した ( Yachie et al., Nature Biotechnol. )
HippoシグナルがSkp2を通じてploidyの維持や造腫瘍性を抑制していることを発見した。Yapが活性化するとAkt依存的にSkp2がアセチル化され、アセチル化Skp2は細胞質に留まるため、p27が核内で蓄積して細胞周期の停止と共にploidyが上昇すると共に、FOXO1/3が分解されて造腫瘍性が上昇することを示した ( Zhang et al., Cancer Cell )
細胞内鉄濃度を制御するユビキチンリガーゼFBXL5の骨髄特異的コンディショナルノックアウトマウスを作製したところ、骨髄幹細胞の機能が喪失することが判明した。また骨髄異型性症候群の患者でFBXL5が低下していることがわかった ( Muto et al., Nature Commun. )
mTORC1の下流で機能する分子をiTRAQ-リン酸化プロテオミクス技術を用いて網羅的に同定し、その中の一つである転写因子FOXK1がCCL2遺伝子の活性化を通じて、がんにおけるCCL2の分泌およびマクロファージの誘引を引き起こしてがんを進展させることを明らかにした ( Nakatsumi et al., Cell Rep. )
mTORC1の活性化調節に関わるRagulator-Rag GTPase複合体の構造を解明し、p18がその構造のscaffoldとして機能していることを明らかにした ( Yonehara et al., Nature Commun. )
Hajdu-Cheney syndrome (HCS)は稀な遺伝病でNotch2の変異によって発症するが、これはNotch2の変異によってFbxw7によるタンパク質分解を免れているためであることをモデルマウスを作製して証明した ( Fukushima et al., Mol. Cell )
2018
マウスの大腸がんモデルで5つのドライバー変異 (Apc, Kras, Tgfbr2, Trp53, Fbxw7)を導入し、原発巣ならびに転移に関する影響を調べた ( Sakai et al., Cancer Res. )
以前からがんとの関係が取り沙汰されていたPKM2よりも、PKM1の方ががん代謝にとって重要であることを示した ( Morita et al., Cancer Cell )
われわれの開発したユビキチン化基質の探索法であるDiPIUSを用いて、Fbxw7の新規基質としてMyRFを同定し、その標的遺伝子群を解明した ( Nakayama et al., J. Biol. Chem. )
プロトルーディンに結合するタンパク質としてTMEM55を同定し、それがv-ATPaseのアセンブリに影響してmTORの活性を調節していることを明らかにした ( Hashimoto et al., Genes Cells )
自閉症の原因遺伝子CHD8に変異がある自閉症患者は痩せ型が多いとされるが、その原因は不明であった。われれわれはCHD8が脂肪分化に関わる遺伝子で、脂肪分化のマスター転写因子C/EBPβと結合し、その転写活性化を促進していることを明らかにした ( Kita et al., Cell Rep. )
われわれは以前に転写因子FOXK1がmTORC1の下流で活性化されることを証明したが、その効果は間接的であると考えられた。今回われわれはPP2AB56がmTORC1に依存的なFOXK1の脱リン酸化に関与していることを突き止めた ( Nakatsumi et al., Genes Cells )
転写因子PU.1が他の転写調節因子をリクルートしたり、本来の場所から移動させることによる影響で、初期T細胞分化における遺伝子発現調節に複雑に関わることを証明した ( Hosokawa et al., Immunity )
T細胞の運命決定を担う転写因子Bcl11bの標的因子を決定し、プロテオミクス解析によって活性に必須の会合分子を発見した。さらにBcl11bはId2とZbtb16を抑制することにより間接的にも様々な遺伝子発現を調節していることを明らかにした ( Hosokawa et al., Nature Immunol. )
2019
乳がんにおけるDTC (disseminated tumor cell) に対してFbxw7遺伝子を破壊して細胞周期を強制的に回転させ、抗がん剤でDTCを死滅させるという静止期追い出し療法の理論的基盤をマウスモデルで実証した ( Shimizu et al., JCI Insight )
肝臓特異的にFBXL5を欠損したマウスに発がん誘発剤を用いると高率にがんが発生することを発見した。FBXL5欠損によって細胞内鉄濃度が過剰となり、酸化ストレスから遺伝子変異が引き起こされていた。つまりFBXL5は有力ながん抑制遺伝子であることが明らかとなった ( Muto et al., J. Exp. Med. )
われわれが開発したDiPIUS法によってユビキチンリガーゼSCF(Fbxw7)複合体の基質としてKLF7を同定した ( Sugiyama et al., Genes Cells )
人工知能を用いて乳がん患者の大規模公開データを解析し、乳がんの予後を決定する23個の遺伝子を発見し、その発現パターンから正確に予後を予測するスコアリングシステム(mPS)を開発した ( Shimizu and Nakayama, EBioMedicine )
ヒートショック時に、Heat Shock Transcription Factor 1 (HSF1) がSGO2と結合し、それがPolIIのプロモーターへのリクルートを促進することを見出した ( Takii et al., EMBO J. )
2020
ProtrudinとPDZD8が複合体を形成し、ERとリソソーム間における膜接触部位を構築し、その間で脂質輸送が行われていることを実証した ( Shirane et al., Nature Commun. )
悪性度の高いがんではグルタミン由来の窒素代謝が大きく偏移していることを次世代プロテオミクス技術(iMPAQT法)を用いて明らかにし、その中心酵素PPATが小細胞肺がんで高発現していることを発見した ( Kodama et al., Nature Commun. )
WntレセプターであるFrizzledをユビキチン化するRNF43がリン酸化によって制御されていることを発見し、この変異によってRNF43の制御がおかしくなるとRasとの協調によって発がんに寄与することが明らかとなった ( Tsukiyama et al., Nature Commun. )
MED26によってリクルートされたLittle Elongation Complex (LEC) はPol IIによる効率的な転写終結を促進するだけでなく、3’-endのプロセッシングも促進することを見出した ( Takahashi et al., Nature Commun. )
p57は大脳の発生に必須であるが、モザイク解析(MADM法)によって、p57は細胞自律的メカニズムと細胞非自律的メカニズムによって細胞の増殖を正負に制御していることが明らかとなった ( Laukoter et al., Nature Commun. )
乳腺特異的なFbxw7コンディショナルノックアウトマウスを作製し、正常な乳腺発達のためにはFbxw7が必要であることを示した。またFbxw7が欠失した乳腺からは、一定期間が経つとヘテロな細胞集団からなる乳がんが発生することが明らかとなった ( Onoyama et al., Cancer Res. )
オリゴデンドロサイト特異的Chd8欠損マウスをMRIで解析し、微小構造や機能的連結の変化を見出した ( Kawamura et al., Mol. Brain )
Protrudin欠損マウスを作製して行動学的解析を行い、うつ様行動異常等の変化を見出した。一方で、痙性対麻痺は認められなかった ( Shirane et al., Mol. Brain )
2021
血液幹細胞特異的Chd8欠損マウスを作製し、CHD8が血液幹細胞からの分化に必須であることを証明した ( Nita et al., Cell Rep. )
老化細胞ではGLS1が高発現してアンモニアを産生し、それによって細胞内pHの低下を防いでいることを発見した。さらにGLS1の阻害薬で老化細胞が除去され、その結果として老化による異常が是正された ( Johmura et al., Science )
人工知能を用いて大腸がんの予後に関わる遺伝子を探索し、16個の遺伝子の発現で予後が決定されることを示した ( Shimizu and Nakayama, NPJ Genom. Med. )
小脳特異的Chd8欠損マウスを作製し、CHD8は運動機能には必須であるものの、自閉症様行動は認められないことを発見した ( Kawamura et al., Cell Rep. )
翻訳開始点を正確に同定するための新規手法(TISCA)を開発し、near-cognateコドンからの翻訳開始は主にeIF2に依存していることを明らかにした ( Ichihara et al., Nucleic Acids Res. )
従来non-coding RNAと信じられていたTINCRが、実は短いユビキチン様タンパク質(TUBL)をコードしており、上皮のケラチノサイトの増殖に関与していることを明らかにした ( Nita et al., PLOS Genet. )
トランスオミクス解析によってインスリンシグナル伝達の複数のレイヤーを統合し、ネットワークの特徴を調べた ( Matsuzaki et al., Cell Rep. )
2022
同一の遺伝子座から産生される二つの双子分子Kastor/PolluksがどちらもVDACと結合し、精子形成や運動に重要な役割を果たしていることを示した ( Mise et al., Nature Commun. )
腸管の+4ポジションに存在するp57+細胞は、通常時には分化細胞として振る舞うが、傷害があると幹細胞性を持つようにリプログラムされることを実証した。このリプログラミングは胎児性変化と胃上皮様変化を伴う時空間的な変化を特徴とすることが明らかとなった ( Higa et al., Nature Commun. )
HSF1のリン酸化はTRRAP-TIP60複合体を介してクロマチンを活性化し、腫瘍発生を促進することを発見した ( Fujimoto et al., Nature Commun. )
任意のタンパク質-化合物の結合を予測する人工知能「LIGHTHOUSE」を開発し、がん・細菌感染症・メタボリックシンドローム・新型コロナウイルス感染症等に有効な化合物を発見した ( Shimizu et al., iScience )
2023
mTORの下流分子をリン酸化プロテオミクス技術で探索したところ、PBX2がmTOR依存的に脱リン酸化されることを発見した ( Wada et al., J. Biochem. )
大腸がんのシングルセル解析によって、従来の幹細胞分画には増殖の速い細胞と遅い細胞があり、後者にはp57が特異的に発現していることを発見した。またこの細胞を焼灼することにより、大腸がんの進行や再発が抑制されることを実証した ( Oka et al., Cancer. Res. )
横紋筋特異的に発現するRPL3Lが筋収縮やミトコンドリア関連のタンパク質の翻訳を制御し、RPL3Lノックアウトマウスは心不全を呈することを発見した ( Shiraishi et al., Nature Commun. )
ASC-1複合体が翻訳リボソームだけでなく走査リボソームにも結合しており、走査リボソームがmRNA上を進みやすくするように補助する機能を持つことを明らかにした ( Kito et al., EMBO J. )
元々海洋生物は祖先型Keap1 (Keap1A) を持っているが、魚類において遺伝子重複によりKeap1Bが出現し、Keap1BはCul3との結合力が弱まってNrf2のユビキチン化活性が低下していることを発見した。生物の陸上進化の際にKeap1Aは失われてKeap1Bのみとなり、その結果高レベルのNrf2が活性酸素に対する防御機構として働いていることがわかった ( Yumimoto et al., Sci. Adv. )
FOXK1の肝臓特異的ノックアウトマウスを作製したところ、高脂肪食による脂肪肝炎が有意に抑制され、発がん率も減少した ( Fujinuma et al., Cell Rep. )
小細胞肺がんにおいてプリン合成のサルベージ経路とde novo経路を6-MPとメソトレキセートで抑制し、さらにグルタミン供給を下げると強い抗がん作用が得られた ( Kodama et al., Cell Rep. )
T細胞の正負の選択に際し、T細胞レセプターからの漸増的なシグナルはRSKのリン酸化の過程でデジタル情報化されることが判明した ( Funasaki et al., iScience )
2024
自閉症患者における点突然変異の影響を予測し、その実証実験を行うことによって、自閉症の発症メカニズムが複数あることを発見した ( Shiraishi et al., Mol. Psychiatry )
脳が酸性に傾く精神・神経疾患モデル動物を多数発⾒し、多様な疾患にまたがる認知機能障害の脳内メカニズムを解明した ( Hagiwara et al., eLife )
c-Mycのユビキチン依存性分解を司る酵素として従来のCRLFbxw7に加えてCRL2KLHDC3を発見した ( Motomura et al., Oncogene )
膵がん患者からオルガノイドを樹立し、そのクラス分けと臨床転帰の予測を行った ( Matsumoto et al., J. Gastroenterol. )
p57遺伝子のエンハンサーを同定し、その欠失や抑制がp57の発現量を低下させることを実証した ( Koga et al., Genes Cells )
2025
がんが肺転移する際に肺と末梢血で免疫細胞分画が特徴的な動態を示すことを発見した ( Sugiyama et al., Cancer Med. )
大腸がんのがん幹細胞にGPLD1が特異的に発現し、WNTシグナルを制御していることを発見した ( Mizoo et al., J. Biochem. )

論文リスト
The latest articles.
Authors’ name links to abstract on PubMed
last update 2025.2.4
2024
Shiraishi T., Katayama Y., Nishiyama M., Shoji H., Miyakawa T., Mizoo T., Matsumoto A., Hijikata A., Shirai T., Mayanagi K., Nakayama KI.
The complex etiology of autism spectrum disorder due to missense mutations of CHD8.
Mol. Psychiatry, 29:2145-60, 2024.
2023
Oka T., Higa T., Sugahara O., Koga D., Nakayama S., Nakayama KI.
Ablation of p57+ quiescent cancer stem cells suppresses recurrence after chemotherapy of intestinal tumors.
Cancer Res., 83: 1393-409, 2023.
Shiraishi C., Matsumoto A., Ichihara K., Yamamoto T., Yokoyama T., Mizoo T., Hatano A., Matsumoto M., Tanaka Y., Matsuura-Suzuki E., Iwasaki S., Matsushima S., Tsutsui H., Nakayama KI.
RPL3L-containing ribosomes determine translation elongation dynamics required for cardiac function.
Nature Commun., 14: 2131, 2023.
Kito Y., Matsumoto A., Ichihara K., Shiraishi C., Tang R., Hatano A., Matsumoto M., Han P., Iwasaki S., Nakayama KI.
The ASC-1 complex promotes translation initiation by scanning ribosomes.
EMBO J., 42: e112869, 2023.
Yumimoto K., Sugiyama S., Motomura S., Takahashi D., Nakayama KI.
Molecular evolution of Keap1 was essential for adaptation of vertebrates to terrestrial life.
Sci. Adv., 9: eadg2379, 2023.
Fujinuma S., Nakatsumi H., Shimizu H., Sugiyama S., Harada A., Goya T., Tanaka M., Kohjima M., Takahashi M., Izumi Y., Yagi M., Kang D., Kaneko M., Shigeta M., Bamba T., Ohkawa Y., Nakayama KI.
FOXK1 promotes nonalcoholic fatty liver disease by mediating mTORC1-dependent inhibition of hepatic fatty acid oxidation.
Cell Rep., 42: 112530, 2023.
Kodama M., Toyokawa G., Sugahara O., Sugiyama S., Haratake N., Yamada Y., Wada R., Takamori S., Shimokawa M., Takenaka T., Tagawa T., Kittaka H., Tsuruda T., Tanaka K., Komatsu Y., Nakata K., Imado Y., Yamazaki K., Okamoto I., Oda Y., Takahashi M., Izumi Y., Bamba Y., Shimizu H., Yoshizumi T., Nakayama KI.
Modulation of host glutamine anabolism enhances the sensitivity of small cell lung cancer to chemotherapy.
Cell Rep., 42: 112899, 2023.
Nomura M., Ohuchi M., Sakamoto Y., Kudo K., Yaku K., Soga T., Sugiura Y., Morita M., Hayashi K., Miyahara S., Sato T., Yamashita Y., Ito S., Kikuchi N., Sato I., Saito R., Yaegashi N., Fukuhara T., Yamada H., Shima H., Nakayama KI., Hirao A., Kawasaki K., Arai Y., Akamatsu S., Tanuma SI., Sato T., Nakagawa T., Tanuma N.
Niacin restriction with NAMPT-inhibition is synthetic lethal to neuroendocrine carcinoma.
Nature Commun.,14: 8095, 2023.
Chadani Y., Kanamori T., Niwa T., Ichihara K., Nakayama KI., Matsumoto A., Taguchi H.
Mechanistic dissection of premature translation termination induced by acidic residues-enriched nascent peptide.
Cell Rep., 42: 113569, 2023.
2022
Mise S., Matsumoto A., Shimada K., Hosaka T., Takahashi M., Ichihara K., Shimizu H., Shiraishi C., Saito D., Suyama M., Yasuda T., Ide T., Izumi Y., Bamba T., Kimura-Someya T., Shirouzu M., Miyata H., Ikawa M., Nakayama KI.
Kastor and Polluks polypeptides encoded by a single gene locus cooperatively regulate VDAC and spermatogenesis.
Nature Commun., 13: 1071, 2022.
Higa T., Okita Y., Matsumoto A., Nakayama S., Oka T., Sugahara O., Koga D., Takeishi S., Nakatsumi H., Hosen N., Robine S., Taketo MM., Sato T., Nakayama KI.
Spatiotemporal reprogramming of differentiated cells underlies regeneration and neoplasia in the intestinal epithelium.
Nature Commun., 13: 1500, 2022.
Fujimoto M., Takii R., Matsumoto M., Okada M., Nakayama KI., Nakato R., Fujiki K., Shirahige K., Nakai A.
HSF1 phosphorylation establishes an active chromatin state via the TRRAP-TIP60 complex and promotes tumorigenesis.
Nature Commun., 13: 4355, 2022.
2021
Nita A., Muto Y., Katayama Y., Matsumoto A., Nishiyama M., Nakayama KI.
The autism-related protein CHD8 contributes to the stemness and differentiation of mouse hematopoietic stem cells.
Cell Rep., 34: 108688, 2021.
Johmura Y., Yamanaka T., Omori S., Wang T-W., Sugiura Y., Matsumoto M., Suzuki N., Kumamoto S., Yamaguchi K., Hatakeyama S., Takami T., Yamaguchi R., Shimizu E., Ikeda K., Okahashi N., Mikawa R., Suematsu M., Arita M., Sugimoto M., Nakayama KI., Furukawa Y., Imoto S., Nakanishi M.
Senolysis by glutaminolysis inhibition ameliorates various age-associated disorders.
Science, 371: 265-70, 2021.
Kawamura A., Katayama Y., Kakegawa W., Ino D., Nishiyama M., Yuzaki M., Nakayama KI.
The autism-associated protein CHD8 is required for cerebellar development and motor function.
Cell Rep., 35: 108932, 2021.
Ichihara K., Matsumoto A., Nishida H., Kito Y., Shimizu H., Shichino Y., Iwasaki S., Imami K., Ishihama Y., Nakayama KI.
Combinatorial analysis of translation dynamics reveals eIF2 dependence of translation initiation at near-cognate codons.
Nucleic Acids Res., 49: 7298-317, 2021.
Matsuzaki F., Uda S., Yamauchi Y., Matsumoto M., Soga T., Maehara K., Ohkawa Y., Nakayama KI., Kuroda S., Kubota H.
An extensive and dynamic trans-omic network illustrating prominent regulatory mechanisms in response to insulin in the liver.
Cell Rep., 36: 109569, 2021.
2020
Laukoter S., Beattie R., Pauler FM., Amberg N., Nakayama KI., Hippenmeyer S.
Imprinted cdkn1c genomic locus cell-autonomously promotes cell survival in cerebral cortex development.
Nature Commun., 11: 195, 2020.
Kodama M., Oshikawa K., Shimizu H., Yoshioka S., Takahashi M., Izumi Y., Bamba T., Tateishi C., Tomonaga T., Matsumoto M., Nakayama KI.
A shift in glutamine nitrogen metabolism contributes to malignant progression of cancer.
Nature Commun., 11: 1320, 2020.
Takahashi H., Ranjan A., Chen S., Suzuki H., Shibata M., Hirose T., Hirose H., Sasaki K., Abe R., Chen K., He Y., Zhang Y., Takigawa I., Tsukiyama T., Watanabe M., Fujii S., Iida M., Yamamoto J., Yamaguchi Y., Suzuki Y., Matsumoto M., Nakayama KI., Washburn MP., Saraf A., Florens L., Sato S., Tomomori-Sato C., Conaway RC., Conaway JW., Hatakeyama S.
The role of Mediator and Little Elongation Complex in transcription termination.
Nature Commun., 11: 1063, 2020.
Tsukiyama T., Juqi Z., Kim J., Ogamino S., Shino Y., Masuda T., Merenda A., Matsumoto M., Fujioka Y., Hirose T., Terai S., Takahashi H., Ishitani T., Nakayama KI., Ohba Y., Koo B-K., Hatakeyama S.
A phospho-switch controls RNF43-mediated degradation of Wnt receptors to suppress tumorigenesis.
Nature Commun., 11: 4586, 2020.
Shirane M., Wada M., Morita K., Hayashi N., Kunimatsu R., Matsumoto Y., Matsuzaki F., Nakatsumi H., Ohta K., Tamura Y., Nakayama KI.
Protrudin and PDZD8 contribute to neuronal integrity by promoting lipid extraction required for endosome maturation.
Nature Commun., 11: 4576, 2020.
Onoyama I., Nakayama S., Shimizu H., Nakayama KI.
Loss of Fbxw7 impairs development of and induces heterogeneous tumor formation in the mouse mammary gland.
Cancer Res., 80: 5515-30, 2020.
2019
Muto Y., Moroishi T., Ichihara K., Nishiyama M., Shimizu H., Eguchi H., Moriya K., Koike K., Mimori K., Mori M., Katayama Y., Nakayama KI.
Disruption of FBXL5-mediated cellular iron homeostasis promotes liver carcinogenesis.
J. Exp. Med., 216: 950-65, 2019.
Takii R., Fujimoto M., Matsumoto M., Srivastava P., Katiyar A., Nakayama KI., Nakai A.
HSF1-SGO2 complex promotes the heat shock response by recruiting RNA polymerase II.
EMBO J., 38: e102566, 2019.
2018
Morita M., Sato T., Nomura M., Sakamoto Y., Inoue Y., Tanaka R., Ito S., Kurosawa K., Yamaguchi K., Sugiura Y., Takizaki H., Yamashita Y., Katakura R., Sato I., Kawai M., Okada Y., Watanabe H., Kondoh G., Matsumoto S., Kishimoto A., Obata M., Matsumoto M., Fukuhara T., Motohashi H., Suematsu M., Komatsu M., Nakayama KI., Watanabe T., Soga T., Shima H., Maemondo M., Tanuma N.
Pkm1 confers metabolic advantages and promotes cell-autonomous tumor cell growth.
Cancer Cell, 33: 355-67, 2018.
Kita Y., Katayama Y., Shiraishi T., Oka T., Sato T., Suyama M., Ohkawa Y., Miyata K., Oike Y., Shirane M., Nishiyama M., Nakayama KI.
The autism-related protein CHD8 cooperates with C/EBPβ to regulate adipogenesis.
Cell Rep., 23: 1988-2000, 2018.
Hosokawa H., Ungerbäck J., Wang X., Matsumoto M., Nakayama KI., Tanaka T., Rothenberg EV.
Transcription factor PU.1 represses and activates gene expression in early T cells by redirecting partner transcription factor binding.
Immunity, 48: 1119-34, 2018.
Hosokawa H., Romero-Wolf M., Yui MA., Ungerbäck J., Quiloan MJG., Matsumoto M., Nakayama KI., Tanaka T., Rothenberg EV.
Bcl11b sets pro-T cell fate by site-specific cofactor recruitment and by repressing Id2 and Zbtb16.
Nature Immunol., 19: 1427-40, 2018.
2017
Matsumoto M., Matsuzaki F., Oshikawa K., Goshima N., Mori M., Kawamura Y., Ogawa K., Fukuda E., Nakatsumi H., Natsume T., Fukui K., Horimoto K., Nagashima T., Funayama R., Nakayama K. & Nakayama KI.
A large-scale targeted proteomics assay resource based on an in vitro human proteome.
Nature Methods, 14: 251-8, 2017.
Matsumoto A., Pasut A., Matsumoto M., Yamashita R., Fung J., Saghatelian A., Nakayama KI., Clohessy JG., Monteleone E., Pandolfi PP.
mTORC1 and muscle regeneration are regulated by the LINC00961 encoded SPAR polypeptide.
Nature, 541: 228-32, 2017.
Yachie N., Robotic Biology Consortium (incl. Matsumoto M., Nakayama KI.), Natsume T.
Robotic crowd biology with Maholo LabDroids.
Nature Biotechnol., 35: 310-2, 2017.
Zhang S., Chen Q., Liu Q., Li Y., Sun X., Hong L., Ji S., Liu C., Geng J., Zhang W., Lu Z., Yin ZY., Zeng Y., Lin KH., Wu Q., Li Q., Nakayama K., Nakayama KI., Deng X., Johnson RL., Zhu L., Gao D., Chen L., Zhou D.
Hippo signaling suppresses cell ploidy and tumorigenesis through Skp2.
Cancer Cell, 31: 669-84, 2017.
Muto Y., Nishiyama M., Nita A., Moroishi T., Nakayama KI.
Essential role of FBXL5-mediated cellular iron homeostasis in maintenance of hematopoietic stem cells.
Nature Commun., 8: 16114, 2017.
Fukushima H., Shimizu K., Watahiki A., Hoshikawa S., Kosho T., Oba D., Sakano S., Arakaki M., Yamada A., Nagashima K., Okabe K., Fukumoto S., Jimi E., Bigas A., Nakayama KI., Nakayama K., Aoki Y., Wei W., Inuzuka H.
NOTCH2 Hajdu-Cheney mutations escape SCFFBW7-dependent proteolysis to promote osteoporosis.
Mol. Cell, 68: 645-58.e5., 2017.
Yonehara R., Nada S., Nakai T., Nakai M., Kitamura A., Ogawa A., Nakatsumi H., Nakayama KI., Li S., Standley DM., Yamashita E., Nakagawa A., Okada M.
Structural basis for the assembly of the Ragulator-Rag GTPase complex.
Nature Commun., 8: 1625, 2017.
Nakatsumi H., Matsumoto M., Nakayama KI.
Noncanonical pathway for regulation of CCL2 expression by an mTORC1-FOXK1 axis promotes recruitment of tumor-associated macrophages.
Cell Rep., 21: 2471-86, 2017.
2016
Katayama Y., Nishiyama M., Shoji H., Ohkawa Y., Kawamura A., Sato T., Suyama M., Takumi T., Miyakawa T., Nakayama KI.
CHD8 haploinsufficiency results in autistic-like phenotypes in mice.
Nature, 537: 675-9, 2016.
2015
Yumimoto K., Akiyoshi S., Ueo H., Sagara Y., Onoyama I., Ueo H., Ohno S., Mori M., Mimori K., Nakayama KI.
F-box protein FBXW7 inhibits cancer metastasis in a non-cell-autonomous manner.
J. Clin. Invest., 125: 621-35, 2015.
Furutachi S., Miya H., Watanabe T., Kawai H., Yamasaki N., Harada Y., Imayoshi I., Nelson M., Nakayama KI., Hirabayashi Y., Gotoh Y.
Slowly dividing neural progenitors are an embryonic origin of adult neural stem cells.
Nature Neurosci., 18: 657-65, 2015.
2014
Lu Z., Bauzon F., Fu H., Cui J., Zhao H., Nakayama K., Nakayama KI., Zhu L.
Skp2 suppresses apoptosis in Rb1 deficient tumors by limiting E2F1 activity.
Nature Commun., 5: 3463, 2014.
*Matsumoto A., *Takeishi S., Nakayama KI. (*Co-first authors)
p57 regulates T-cell development and prevents lymphomagenesis by balancing p53 activity and pre-TCR signaling.
Blood, 123: 3429-39, 2014.
Kanatsu-Shinohara M., Onoyama I., Nakayama KI., Shinohara T.
SCF-type ubiquitin ligase Fbxw7 negatively regulates spermatogonial stem cell self-renewal.
Proc. Natl. Acad. Sci. U.S.A., 111: 8826-31, 2014.
Yugi K., Kubota H., Toyoshima Y., Noguchi R., Kawata K., Komori Y., Uda S., Kunida K., Tomizawa Y., Funato Y., Miki H., Matsumoto M., Nakayama KI., Kashikura K., Endo K., Ikeda K., Soga T., Kuroda S.
Reconstruction of insulin signal flow from phosphoproteome and metabolome data.
Cell Rep., 8: 1171-83, 2014.
2013
Saita S., Shirane M., Nakayama KI.
Selective escape of proteins from mitochondria during mitophagy.
Nature Commun., 4: 1410, 2013.
Takeishi S., Matsumoto A., Onoyama I., Naka K., Hirao A., Nakayama KI.
Ablation of Fbxw7 eliminates leukemia-initiating cells by preventing quiescence.
Cancer Cell, 23: 347-61, 2013.
Reavie L., Buckley SM., Loizou E., Takeishi S., Aranda-Orgilles B., Ndiaye-Lobry D., Abdel-Wahab O., Ibrahim S., Nakayama KI., Aifantis I.
Regulation of c-Myc ubiquitination controls chronic myelogenous leukemia initiation and progression.
Cancer Cell, 23: 362-75, 2013.
Hirano A., Yumimoto K., Tsunematsu R., Matsumoto M., Oyama M., Kozuka-Hata H., Nakagawa T., Lanjakornsiripan D., *Nakayama KI., *Fukada Y. (*Co-corresponding authors)
FBXL21 regulates oscillation of the circadian clock through ubiquitination and stabilization of cryptochromes.
Cell, 152: 1106-18, 2013.
Zhao H., Bauzon F., Fu H., Lu Z., Cui J., Nakayama K., Nakayama KI., Locker J., Zhu L.
Skp2 deletion unmasks a p27 safeguard that blocks tumorigenesis in the absence of pRb and p53 tumor suppressors.
Cancer Cell, 24: 645-59, 2013.
2012
Chan CH., Li CF., Yang WL., Gao Y., Lee SW., Feng Z., Huang HY., Tsai KKC., Flores LG., Shao Y., Hazle JD., Yu D., Wei W., Sarbassov D., Hung MC., Nakayama KI., Lin HK.
The Skp2-SCF E3 ligase regulates Akt ubiquitination, glycolysis, Herceptin sensitivity and tumorigenesis.
Cell, 149: 1098-111, 2012.
Fukushima H., Matsumoto A., Inuzuka H., Zhai B., Lau AW., Wan L., Gao D., Shaik S., Yuan M., Gygi SP., Jimi E., Asara JM., Nakayama K., Nakayama KI., Wei W.
SCFFbw7 modulates the NFkB signaling pathway by targeting NFkB2 for ubiquitination and destruction.
Cell Rep., 1: 434-43, 2012.
Okita Y., Nakayama KI.
UPS delivers pluripotency.
Cell Stem Cell, 11: 728-30, 2012.
2011
Onoyama I., Suzuki A., Matsumoto A., Tomita K., Katagiri H., Oike Y., Nakayama K., Nakayama KI.
Fbxw7 regulates lipid metabolism and cell fate decisions in the mouse liver.
J. Clin. Invest., 121: 342-54, 2011.
Inuzuka H., Shaik S., Onoyama I., Tseng A., Gao D., Maser R., Zhai B., Gutierrez A., Wan L., Lau A., Xiao Y., Christie A., Aster J., Settleman J., Kung AL., Gygi SP., Look T., Nakayama KI., DePinho RA., Wei W.
SCFFbw7 regulates cellular apoptosis by targeting the Mcl-1 oncoprotein for ubiquitination and destruction.
Nature, 471: 104-9, 2011.
Katagiri K., Ueda Y., Tomiyama T., Yasuda K., Toda Y., Ikehara S., Nakayama KI., Kinashi T.
Deficiency of Rap1-GTP binding protein RAPL causes lymphoproliferative disorders through the mislocalization of cyclin-dependent kinase inhibitor p27kip1.
Immunity, 34: 24-38, 2011.
Wu H., Pomeroy SL., Ferreira M., Teider N., Mariani J., Nakayama KI., Hatakeyama S., Tron VA., Saltibus LF., Spyracopoulos L., Leng RP.
UBE4B promotes Hdm2-mediated degradation of the tumor suppressor p53.
Nature Med., 17: 347-55, 2011.
Matsumoto A., Takeishi S., Kanie T., Susaki E., Onoyama I., Tateishi Y., Nakayama K., Nakayama KI.
p57 is required for quiescence and maintenance of adult hematopoietic stem cells.
Cell Stem Cell, 9: 262-71, 2011.
Moroishi T., Nishiyama M., Takeda Y., Iwai K., Nakayama KI.
The FBXL5-IRP2 axis is integral to control of iron metabolism in vivo.
Cell Metab., 14: 339-51, 2011.
Zou P., Yoshihara H., Hosokawa K., Tai I., Shinmyozu K., Tsukahara F., Maru Y., Nakayama K., Nakayama KI., Suda T.
p57(Kip2) and p27(Kip1) cooperate to maintain hematopoietic stem cell quiescence through interactions with Hsc70.
Cell Stem Cell, 9: 247-61, 2011.
2010
Wang H., Bauzon F., Ji P., Xu X., Sun D., Locker J., Sellers RS., Nakayama K., Nakayama KI., Cobrinik D., Zhu L.
Skp2 is required for survival of aberrantly proliferating Rb1-deficient cells and for tumorigenesis in Rb1(+/-) mice.
Nature Genet., 42: 83-8, 2010.
Tsukada Y., Ishitani T., Nakayama KI.
KDM7 is a dual demethylase for histone H3 lysines 9 and 27 and functions in brain development.
Genes Dev., 24: 432-7, 2010.
Lin HK., Chen Z., Wang G., Nardella C., Lee SW., Chan CH., Yang WL., Wang J., Egia A., Nakayama KI., Cordon-Cardo C., Teruya-Feldstein J., Pandolfi PP.
Skp2 targeting suppresses tumourigenesis through p19Arf/p53-independent cellular senescence.
Nature, 464: 374-9, 2010.
Chan CH., Lee SW., Li CF., Wang J., Yang WL., Wu1 CY., Wu J., Nakayama KI., Kang HY., Huang HY., Hung MC., Pandolfi PP., Lin HK.
Deciphering the transcription complex critical for RhoA gene expression and cancer metastasis.
Nature Cell Biol., 12: 457-67, 2010.
2009
Nishiyama M., Oshikawa K., Tsukada Y., Nakagawa T., Iemura S., Natsume T., Fan Y., Kikuchi A., Skoultchi AI., Nakayama KI.
CHD8 suppresses p53-mediated apoptosis through histone H1 recruitment during early embryogenesis.
Nature Cell Biol., 11: 172-82, 2009.
Susaki E., Nakayama K., Yamasaki L., Nakayama KI.
Common and specific roles of the related CDK inhibitors p27 and p57 revealed by a knock-in mouse model.
Proc. Natl. Acad. Sci. U.S.A., 106: 5192-7, 2009.
Lin HK., Wang G., Chen Z., Teruya-Feldstein J., Liu Y., Chan CH., Yang WL., Erdjument-Bromage H., Nakayama KI., Nimer S., Tempst P., Pandolfi PP.
Phosphorylation-dependent regulation of cytosolic localization and oncogenic function of Skp2 by Akt/PKB.
Nature Cell Biol., 11: 420-32, 2009.
2008
Inoue S., Kinoshita T., Matsumoto M., Nakayama KI., Doi M., Shimazaki K.
Blue light-induced autophosphorylation of phototropin is a primary step for signaling.
Proc. Natl. Acad. Sci. U.S.A., 105: 5626-31, 2008.
Matsuoka S., Oike Y., Onoyama I., Iwama A., Arai F., Takubo K., Mashimo Y., Oguro H., Nitta E., Ito K., Miyamoto K., Yoshiwara H., Hosokawa K., Nakamura Y., Gomei Y., Iwasaki H., Hayashi Y., Matsuzaki Y, Nakayama K., Ikeda Y., Hata A., Chiba S., Nakayama KI., Suda T.
Fbxw7 acts as a critical failsafe against premature loss of hematopoietic stem cells and development of T-ALL.
Genes Dev., 22: 986-91, 2008.
Miranda-Carboni GA., Krum SA., Yee K., Nava M., Deng QE., Pervin S., Collado-Hidalgo A., Galic Z., Zack JA., Nakayama K., Nakayama KI., Lane TF.
A functional link between Wnt signaling and SKP2-independent p27 turnover in mammary tumors.
Genes Dev., 22: 3121-34, 2008.
2007
Tu X., Joeng KS., Nakayama KI., Nakayama K., Rajagopal J., Carroll TJ., McMahon AP., Long F.
Noncanonical Wnt signaling through G protein-linked PKCdelta activation promotes bone formation.
Dev. Cell, 12: 113-27, 2007.
Miyamoto K., Araki KY., Naka K., Arai F., Takubo K., Yamazaki S., Matsuoka S., Miyamoto T., Ito K., Ohmura M., Chen C., Hosokawa K., Nakauchi H., Nakayama K., Nakayama KI., Harada M., Motoyama N., Suda T., Hirao A.
Foxo3a is essential for maintenance of the hematopoietic stem cell pool.
Cell Stem Cell, 1: 101-12, 2007.
Zhong L., Georgia S., Tschen S., Nakayama K., Nakayama KI., Bhushan A.
Skp2-mediated p27 degradation plays an essential role in the growth and adaptive expansion of pancreatic beta cells.
J. Clin. Invest., 117: 2869-76, 2007.
Onoyama I., Tsunematsu R., Matsumoto A., Kimura T., de Alboran IM., Nakayama K., Nakayama KI.
Conditional inactivation of Fbxw7 impairs cell cycle exit during T cell differentiation and results in lymphomatogenesis.
J. Exp. Med., 204: 2875-88, 2007.
2006
Shirane M., Nakayama KI.
Protrudin induces neurite formation by directional membrane trafficking.
Science, 314: 818-21, 2006.
Nishitani H., Sugimoto N., Roukos V., Nakanishi Y., Saijo M., Obuse C., Tsurimoto T., Nakayama KI., Nakayama K., Fujita M., Lygerou Z., Nishimoto T.
Two E3 ubiquitin ligases, SCF-Skp2 and DDB1-Cul4, target human Cdt1 for proteolysis.
EMBO J., 25: 1126-36, 2006.
Niki S., Oshikawa K., Mouri Y., Hirota F., Matsushima A., Yano M., Han H., Bando Y., Izumi K., Matsumoto M., Nakayama KI., Kuroda N., Matsumoto M.
Alteration of intra-pancreatic target-organ specificity by abrogation of Aire in NOD mice.
J. Clin. Invest., 116: 1292-1301, 2006.
Nakayama KI., Nakayama K.
Ubiquitin ligases: cell-cycle control and cancer.
Nature Rev. Cancer, 6: 369-81, 2006.
Pula G., Schuh K., Nakayama K., Nakayama KI., Walter U., Poole AW.
PKCδ regulates collagen-induced platelet aggregation through inhibition of VASP-mediated filopodia formation.
Blood, 108: 4035-44, 2006.
Takahashi A., Ohtani N., Yamakoshi K., Iida S., Tahara H., Nakayama K., Nakayama KI., Ide T., Saya H., Hara E.
Mitogenic signalling and the p16INK4a/Rb pathway co-operate to enforce irreversible cellular senescence through activating ROS/PKC-δ signalling pathway.
Nature Cell Biol., 8: 1291-7, 2006.
2005
Rodier G., Makris C., Coulombe P., Nakayama K., Nakayama KI., Meloche S.
p107 inhibits G1 phase progression by down-regulating expression of the F-box protein Skp2.
J. Cell Biol., 168: 55-66, 2005.
Uchida T., Nakamura T., Hashimoto N., Matsuda T., Kotani K., Sakaue H., Kido Y., Hayashi Y., Nakayama KI, White MF., Kasuga M.
Deletion of Cdkn1b ameliorates hyperglycemia by maintaining compensatory hyperinsulinemia in diabetic mice.
Nature Med., 11: 175-82, 2005.
Jiang H., Chang FC., Ross AE., Lee J., Nakayama KI., Nakayama K, Desiderio S.
Ubiquitylation of RAG-2 by Skp2-SCF links destruction of the V(D)J recombinase to the cell cycle.
Mol. Cell, 18: 699-709, 2005.
Chen Z., Foster MW., Zhang J., Mao L., Rockman HA., Kawamoto T., Kitagawa K., Nakayama KI., Hess DT., Stamler JS.
An essential role for mitochondrial aldehyde dehydrogenase in nitroglycerin bioactivation.
Proc. Natl. Acad. Sci. U.S.A., 102: 12159-64, 2005.
2004
Nakayama K., Nagahama H., Minamishima YA., Miyake S., Ishida N., Hatakeyama S., Kitagawa M., Iemura S., Natsume T., Nakayama KI.
Skp2-mediated degradation of p27 regulates progression into mitosis.
Dev. Cell, 6: 661-72, 2004.
Kamura T., Hara T., Matsumoto M., Ishida N., Okumura F., Hatakeyama S., Yoshida M., Nakayama K., Nakayama KI.
Cytoplasmic ubiquitin ligase KPC regulates proteolysis of p27(Kip1) at G1 phase.
Nature Cell Biol., 6: 1229-35, 2004.
Uchida D., Hatakeyama S., Matsushima A., Han H., Ishido S., Hotta H., Kudoh J., Shimizu N., Doucas V., Nakayama KI., Kuroda N., Matsumoto M.
AIRE Functions As an E3 Ubiquitin Ligase.
J. Exp. Med., 199: 167-72, 2004.
Matsumoto M., Yada M., Hatakeyama S., Ishimoto H., Tanimura T., Tsuji S., Kakizuka A., Kitagawa M., Nakayama KI.
Molecular clearance of ataxin-3 is regulated by a mammalian E4.
EMBO J., 23: 659-69, 2004.
Ohtsuka T., Ryu H., Minamishima YA., Macip S., Sagara J., Nakayama KI., Aaronson SA., Lee SW.
ASC is a Bax adaptor and regulates the p53-Bax mitochondrial apoptosis pathway.
Nature Cell Biol., 6: 121-8, 2004.
Yada M., Hatakeyama S., Kamura T., Nishiyama M., Tsunematsu R., Imaki H., Ishida N., Okumura F., Nakayama K., Nakayama KI.
Phosphorylation-dependent degradation of c-Myc is mediated by the F-box protein Fbw7.
EMBO J., 23: 2116-25, 2004.
Li B., Wang X., Rasheed N., Hu Y., Boast S., Ishii T., Nakayama K., Nakayama KI., Goff SP.
Distinct roles of c-Abl and Atm in oxidative stress response are mediated by protein kinase Cδ.
Genes Dev., 18: 1824-37, 2004.
Kamura T., Maenaka K., Kotoshiba S., Matsumoto M., Kohda D., Conaway RC., Conaway JW., Nakayama KI.
VHL-box and SOCS-box domains determine binding specificity for Cul2-Rbx1 and Cul5-Rbx2 modules of ubiquitin ligases.
Genes Dev., 18: 3055-65, 2004.
Mao JH., Perez-losada J., Wu D., DelRosario R., Tsunematsu R., Nakayama KI., Brown K., Bryson S., Balmain A.
Fbxw7/Cdc4 is a p53-dependent, haploinsufficient tumour suppressor gene.
Nature, 432: 775-9, 2004.
2003
Shirane M, Nakayama KI.
Inherent calcineurin inhibitor FKBP38 targets Bcl-2 to mitochondria and inhibits apoptosis.
Nature Cell Biol., 5: 28-37, 2003.
Kamura T., Hara T., Kotoshiba S., Yada M., Ishida N., Imaki H., Hatakeyama S., Nakayama K., Nakayama KI.
Degradation of p57Kip2 mediated by SCFSkp2-dependent ubiquitylation.
Proc. Natl. Acad. Sci. U.S.A., 100: 10231-6, 2003.
von der Lehr N., Johansson S., Wu S., Bahram F., Castell A., Cetinkaya C., Hydbring P., Weidung I., Nakayama K., Nakayama KI., Soderberg O., Kerppola TK., Larsson LG.
The F-box protein Skp2 participates in c-Myc proteosomal degradation and acts as a cofactor for c-Myc-regulated transcription.
Mol. Cell, 11: 1189-200, 2003.
Nakayama K., Hatakeyama S., Maruyama S., Kikuchi A., Onoe K., Good RA., Nakayama KI.
Impaired degradation of inhibitory subunit of NF-kappa B (I kappa B) and beta-catenin as a result of targeted disruption of the beta-TrCP1 gene.
Proc. Natl. Acad. Sci. U.S.A., 100: 8752-7, 2003.
2002
Miyamoto A., Nakayama K., Imaki H., Hirose S., Jiang Y., Abe M., Tsukiyama T., Nagahama H., Ohno S., Hatakeyama S., Nakayama KI.
Increased proliferation of B cells and auto-immunity in mice lacking protein kinase Cdelta.
Nature, 416: 865-9, 2002.
Yamanaka A., Yada M., Imaki H., Koga M., Ohshima Y., Nakayama KI.
Multiple Skp1-related proteins in Caenorhabditis elegans: diverse patterns of interaction with Cullins and F-box proteins.
Curr. Biol., 12: 267-75, 2002.
Kanematsu T., Jang IS., Yamaguchi T., Nagahama H., Yoshimura K., Hidaka K., Matsuda M., Takeuchi H., Misumi Y., Nakayama K., Yamamoto T., Akaike N., Hirata M., Nakayama KI.
Role of the PLC-related, catalytically inactive protein p130 in GABA(A) receptor function.
EMBO J., 21: 1004-11, 2002.
Imai Y., Soda M., Hatakeyama S., Akagi T., Hashikawa T., Nakayama KI., Takahashi R.
CHIP is associated with Parkin, a gene responsible for familial Parkinson’s disease, and enhances its ubiquitin ligase activity.
Mol. Cell, 10: 55-67, 2002.
2001
Xiang Z., Ahmed AA., Moller C., Nakayama KI., Hatakeyama S., Nilsson G.
Essential role of the prosurvival bcl-2 homologue A1 in mast cell survival after allergic activation.
J. Exp. Med., 194: 1561-70, 2001.
2000
Nakayama K., Nagahama H., Minamishima YA., Matsumoto M., Nakamichi I., Kitagawa K., Shirane M., Tsunematsu R., Tsukiyama T., Ishida N., Kitagawa M., *Nakayama KI., Hatakeyama S.
(*Corresponding author)Targeted disruption of Skp2 results in accumulation of cyclin E and p27(Kip1), polyploidy and centrosome overduplication.
EMBO J., 19: 2069-81, 2000.
Takai H., Tominaga K., Motoyama N., Minamishima YA., Nagahama H., Tsukiyama T., Ikeda K., Nakayama K., Nakanishi M., Nakayama KI.
Aberrant cell cycle checkpoint function and early embryonic death in Chk1(-/-) mice.
Genes Dev., 14: 1439-47, 2000.
Tojima Y., Fujimoto A., Delhase M., Chen Y., Hatakeyama S., Nakayama KI., Kaneko Y., Nimura Y., Motoyama N., Ikeda K., Karin M., Nakanishi M.
NAK is an IkappaB kinase-activating kinase.
Nature, 404: 778-82, 2000.
Shimoda K., Kato K., Aoki K., Matsuda T., Miyamoto A., Shibamori M., Yamashita M., Numata A., Takase K., Kobayashi S., Shibata S., Asano Y., Gondo H., Sekiguchi K., Nakayama K., Nakayama T., Okamura T., Okamura S., Niho Y., Nakayama KI.
Tyk2 plays a restricted role in IFN alpha signaling, although it is required for IL-12-mediated T cell function.
Immunity, 13: 561-71, 2000.
1999
Kitagawa M., Hatakeyama S., Shirane M., Matsumoto M., Ishida N., Hattori K., Nakamichi I., Kikuchi A., Nakayama KI., Nakayama K.
An F-box protein, FWD1, mediates ubiquitin-dependent proteolysis of beta-catenin.
EMBO J., 18: 2401-10, 1999.
Hatakeyama S., Kitagawa M., Nakayama K., Shirane M., Matsumoto M., Hattori K., Higashi H., Nakano H., Okumura K., Onoe K., Good RA., Nakayama KI.
Ubiquitin-dependent degradation of IkappaBalpha is mediated by a ubiquitin ligase Skp1/Cul 1/F-box protein FWD1.
Proc. Natl. Acad. Sci. U.S.A., 96: 3859-63, 1999.
1998
Hamasaki A., Sendo F., Nakayama K., Ishida N., Negishi I., Nakayama KI., Hatakeyama S.
Accelerated neutrophil apoptosis in mice lacking A1-a, a subtype of the bcl-2-related A1 gene.
J. Exp. Med., 188: 1985-92, 1998.
1997
Matsuzaki Y., Nakayama KI., Nakayama K., Tomita T., Isoda M., Loh DY., Nakauchi H.
Role of bcl-2 in the development of lymphoid cells from the hematopoietic stem cell.
Blood, 89: 853-62, 1997.
1996
Nakayama K., Ishida N., Shirane M., Inomata A., Inoue T., Shishido N., Horii I., Loh DY., Nakayama KI.
Mice lacking p27(Kip1) display increased body size, multiple organ hyperplasia, retinal dysplasia, and pituitary tumors.
Cell, 85: 707-20, 1996.
1995
Motoyama N., Wang F., Roth KA., Sawa H., Nakayama KI., Nakayama K., Negishi I., Senju S., Zhang Q., Fujii S., Loh DY.
Massive cell death of immature hematopoietic cells and neurons in Bcl-x-deficient mice.
Science, 267: 1506-10, 1995.
Negishi I., Motoyama N., Nakayama KI., Nakayama K., Senju S., Hatakeyama S., Zhang Q., Chan AC., Loh DY.
Essential role for ZAP-70 in both positive and negative selection of thymocytes.
Nature, 376: 435-8, 1995.
Nakayama KI., Nakayama K., Dustin LB., Loh DY.
T-B cell interaction inhibits spontaneous apoptosis of mature lymphocytes in Bcl-2-deficient mice.
J. Exp. Med., 182: 1101-10, 1995.
1994
Nakayama KI., Nakayama K., Negishi I., Kuida K., Louie MC., Kanagawa O., Nakauchi H., Loh DY.
Requirement for CD8 beta chain in positive selection of CD8-lineage T cells.
Science, 263: 1131-3, 1994.
Nakayama K., Nakayama KI., Negishi I., Kuida K., Sawa H., Loh DY.
Targeted disruption of Bcl-2 alpha beta in mice: occurrence of gray hair, polycystic kidney disease, and lymphocytopenia.
Proc. Natl. Acad. Sci. U.S.A., 91: 3700-4, 1994.
1993
Nakayama KI., Nakayama K., Negishi I., Kuida K., Shinkai Y., Louie MC., Fields LE., Lucas PJ., Stewart V., Alt FW., Loh DY.
Disappearance of the lymphoid system in Bcl-2 homozygous mutant chimeric mice.
Science, 261: 1584-8, 1993.
Shinkai Y., Koyasu S., Nakayama KI., Murphy KM., Loh DY., Reinherz EL., Alt FW.
Restoration of T cell development in RAG-2-deficient mice by functional TCR transgenes.
Science, 259: 822-5, 1993.
1992
Nakayama KI., Loh DY.
No requirement for p56lck in the antigen-stimulated clonal deletion of thymocytes.
Science, 257: 94-6, 1992.
2025
Mizoo T., Oka T., Sugahara O., Minato T., Higa T., Nakayama KI.
GPLD1+ cancer stem cells contribute to chemotherapy resistance and tumor relapse in intestinal cancer.
J. Biochem., Online ahead of print, 2025.
Sugiyama S., Yumimoto K., Nakayama KI.
Immune cell profiling reveals a common pattern in premetastatic niche formation across various cancer types.
Cancer Med., 14: e70557, 2025.
2024
Koga D., Nakayama S., Higa T., Nakayama KI.
Identification and characterization of an enhancer element regulating expression of Cdkn1c (p57 gene).
Genes Cells, 29:1264-74, 2024.
Shiraishi T., Katayama Y., Nishiyama M., Shoji H., Miyakawa T., Mizoo T., Matsumoto A., Hijikata A., Shirai T., Mayanagi K., Nakayama KI.
The complex etiology of autism spectrum disorder due to missense mutations of CHD8.
Mol. Psychiatry, 29:2145-60, 2024.
Sugiyama S., Yumimoto K., Fujinuma S., Nakayama KI.
Identification of effective CCR2 inhibitors for cancer therapy using humanized mice.
J. Biochem., 175: 195-204, 2024.
Hagiwara H., (incl. Nakayama KI.), Miyagawa T.
Large-scale animal model study uncovers altered brain pH and lactate levels as a transdiagnostic endophenotype of neuropsychiatric disorders involving cognitive impairment.
eLife, 12:RP89376, 2024.
Igami K., Kittaka H., Yagi M., Gotoh K., Matsushima Y., Ide T, Ikeda M., Ueda S, Nitta S.-i., Hayakawa M., Nakayama KI., Matsumoto M., Kang D., Uchiumi T.
iMPAQT reveals that adequate mitohormesis from TFAM overexpression leads to life extension in mice.
Life Sci. Alliance, 25: e202302498, 2024.
Motomura S., Yumimoto K., Tomonaga T., Nakayama KI.
CRL2KLHDC3 and CRL1Fbxw7 cooperatively mediate c-Myc degradation.
Oncogene, 43: 1917-1929, 2024.
Matsumoto K, Fujimori N, Ichihara K, Takeno A, Murakami M, Ohno A, Kakehashi S, Teramatsu K, Ueda K, Nakata K, Sugahara O, Yamamoto T, Matsumoto A, Nakayama KI, Oda Y, Nakamura M, Ogawa Y.
Patient-derived organoids of pancreatic ductal adenocarcinoma for subtype determination and clinical outcome prediction.
J. Gastroenterol., Online ahead of print, 2024.
2023
Ichihara K., Nakayama KI., Matsumoto A.
Identification of unannotated coding sequences and their physiological functions.
J. Biochem., 173: 237-42, 2023.
Wada R., Fujinuma S., Nakatsumi H., Matsumoto M., Nakayama KI.
Phosphorylation of PBX2, a novel downstream target of mTORC1, is determined by GSK3 and PP1.
J. Biochem., 173: 129-38, 2023.
Lozano-Ureña A., Lázaro-Carot L., Jiménez-Villalba E., Montalbán-Loro R., Mateos-White I., Duart-Abadía P., Martínez-Gurrea I., Nakayama KI., Fariñas I, Kirstein M., Gil-Sanz C., Ferrón SR.
IGF2 interacts with the imprinted gene Cdkn1c to promote terminal differentiation of neural stem cells.
Development, 150: dev200563, 2023.
Takahashi K., Amano H., Urano T., Li M., Oki M., Aoki K., Amizuka N., Nakayama KI., Nakayama K., Udagawa N., Higashi N.
p57Kip2 is an essential regulator of vitamin D receptor-dependent mechanisms.
PLoS One, 18: e02768382023, 2023.
Oka T., Higa T., Sugahara O., Koga D., Nakayama S., Nakayama KI.
Ablation of p57+ quiescent cancer stem cells suppresses recurrence after chemotherapy of intestinal tumors.
Cancer Res., 83: 1393-409, 2023.
Shiraishi C., Matsumoto A., Ichihara K., Yamamoto T., Yokoyama T., Mizoo T., Hatano A., Matsumoto M., Tanaka Y., Matsuura-Suzuki E., Iwasaki S., Matsushima S., Tsutsui H., Nakayama KI.
RPL3L-containing ribosomes determine translation elongation dynamics required for cardiac function.
Nature Commun., 14: 2131, 2023.
Kito Y., Matsumoto A., Ichihara K., Shiraishi C., Tang R., Hatano A., Matsumoto M., Han P., Iwasaki S., Nakayama, KI.
The ASC-1 complex promotes translation initiation by scanning ribosomes.
EMBO J., 42: e112869, 2023.
Yumimoto K., Sugiyama S., Motomura S., Takahashi D., Nakayama KI.
Molecular evolution of Keap1 was essential for adaptation of vertebrates to terrestrial life.
Sci. Adv., 9: eadg2379, 2023.
Fujinuma S., Nakatsumi H., Shimizu H., Sugiyama S., Harada A., Goya T., Tanaka M., Kohjima M., Takahashi M., Izumi Y., Yagi M., Kang D., Kaneko M., Shigeta M., Bamba T., Ohkawa Y., Nakayama KI.
FOXK1 promotes nonalcoholic fatty liver disease by mediating mTORC1-dependent inhibition of hepatic fatty acid oxidation.
Cell Rep., 42: 112530, 2023.
Kodama M., Toyokawa G., Sugahara O., Sugiyama S., Haratake N., Yamada Y., Wada R., Takamori S., Shimokawa M., Takenaka T., Tagawa T., Kittaka H., Tsuruda T., Tanaka K., Komatsu Y., Nakata K., Imado Y., Yamazaki K., Okamoto I., Oda Y., Takahashi M., Izumi Y., Bamba Y., Shimizu H., Yoshizumi T., Nakayama KI.
Modulation of host glutamine anabolism enhances the sensitivity of small cell lung cancer to chemotherapy.
Cell Rep., 42: 112899, 2023.
Funasaki S., Hatano A., Nakatsumi H., Koga D., Sugahara O., Yumimoto K., Baba M., Matsumoto M., Nakayama KI.
A stepwise and digital pattern of RSK phosphorylation determines the outcome of thymic selection.
iScience, 26: 107552, 2023.
Maehara H., Kokaji T., Hatano A., Suzuki Y., Matsumoto M., Nakayama KI., Egami R., Tsuchiya T., Ozaki H., Morita K., Shirai M., Li D., Terakawa A., Uematsu S., Hironaka K. I., Ohno S., Kubota H., Araki H., Miura F., Ito T., Kuroda S.
DNA hypomethylation characterizes genes encoding tissue-dominant functional proteins in liver and skeletal muscle.
Sci. Rep., 13: 19118, 2023.
Nomura M., Ohuchi M., Sakamoto Y., Kudo K., Yaku K., Soga T., Sugiura Y., Morita M., Hayashi K., Miyahara S., Sato T., Yamashita Y., Ito S., Kikuchi N., Sato I., Saito R., Yaegashi N., Fukuhara T., Yamada H., Shima H., Nakayama KI., Hirao A., Kawasaki K., Arai Y., Akamatsu S., Tanuma SI., Sato T., Nakagawa T., Tanuma N.
Niacin restriction with NAMPT-inhibition is synthetic lethal to neuroendocrine carcinoma.
Nat. Commun.,14: 8095, 2023.
Chadani Y., Kanamori T., Niwa T., Ichihara K., Nakayama KI., Matsumoto A., Taguchi H.
Mechanistic dissection of premature translation termination induced by acidic residues-enriched nascent peptide.
Cell Rep., 42: 113569, 2023.
Temma Y., Obi-Nagata K., Hoshiba Y., Miyake R., Katayama Y., Hagihara H., Suzuki N., Miyakawa T., Nakayama KI., Hayashi-Takagi A.
Effect of brain acidification on depression-related behaviors in diabetes mellitus.
Front. Psychiatry, 14: 1277097, 2023.
2022
Sakaguchi C., Ichihara K., Nita A., Katayama Y., Nakayama KI.
Identification and characterization of novel proteins associated with CHD4.
Genes Cells, 27: 61-71, 2022.
Mise S., Matsumoto A., Shimada K., Hosaka T., Takahashi M., Ichihara K., Shimizu H., Shiraishi C., Saito D., Suyama M., Yasuda T., Ide T., Izumi Y., Bamba T., Kimura-Someya T., Shirouzu M., Miyata H., Ikawa M., Nakayama KI.
Kastor and Polluks polypeptides encoded by a single gene locus cooperatively regulate VDAC and spermatogenesis.
Nature Commun., 13: 1071, 2022.
Higa T., Okita Y., Matsumoto A., Nakayama S., Oka T., Sugahara O., Koga D., Takeishi S., Nakatsumi H., Hosen N., Robine S., Taketo MM., Sato T., Nakayama KI.
Spatiotemporal reprogramming of differentiated cells underlies regeneration and neoplasia in the intestinal epithelium.
Nature Commun., 13: 1500, 2022.
Uematsu S., Ohno S., Tanaka KY., Hatano A., Kokaji T., Ito Y., Kubota H., Hironaka K. I., Suzuki Y., Matsumoto M., Nakayama KI., Hirayama A., Soga T., Kuroda S.
Multi-omics-based label-free metabolic flux inference reveals obesity-associated dysregulatory mechanisms in liver glucose metabolism.
iScience, 25: 103787, 2022.
Fujimoto M., Takii R., Matsumoto M., Okada M., Nakayama KI., Nakato R., Fujiki K., Shirahige K., Nakai A.
HSF1 phosphorylation establishes an active chromatin state via the TRRAP-TIP60 complex and promotes tumorigenesis.
Nature Commun., 13: 4355, 2022.
Huda N., Khambu B., Liu G., Nakatsumi H., Yan S., Chen X., Ma M., Dong Z., Nakayama KI., Yin XM.
Senescence connects autophagy deficiency to inflammation and tumor progression in the liver.
Cell. Mol. Gastroenterol. Hepatol., 14: 333-55, 2022.
Shimizu H., Kodama M., Matsumoto M., Orba Y., Sasaki M., Sato A., Sawa H., Nakayama KI.
LIGHTHOUSE illuminates therapeutics for a variety of diseases including COVID-19
iScience, 25: 105314, 2022.
2021
Nita A., Muto Y., Katayama Y., Matsumoto A., Nishiyama M., Nakayama KI.
The autism-related protein CHD8 contributes to the stemness and differentiation of mouse hematopoietic stem cells.
Cell Rep., 34: 108688, 2021.
Johmura Y., Yamanaka T., Omori S., Wang T-W., Sugiura Y., Matsumoto M., Suzuki N., Kumamoto S., Yamaguchi K., Hatakeyama S., Takami T., Yamaguchi R., Shimizu E., Ikeda K., Okahashi N., Mikawa R., Suematsu M., Arita M., Sugimoto M., Nakayama KI., Furukawa Y., Imoto S., Nakanishi M.
Senolysis by glutaminolysis inhibition ameliorates various age-associated disorders.
Science, 371: 265-70, 2021.
Shimizu H., Nakayama KI.
A universal molecular prognostic score for gastrointestinal tumors.
NPJ Genom. Med., 6: 6, 2021.
Egami R., Kokaji T., Hatano A., Yugi K., Eto M., Morita K., Ohno S., Fujii M., Hironaka K., Uematsu S., Terakawa A., Bai Y., Pan Y., Tsuchiya T., Ozaki H., Inoue H., Uda S., Kubota H., Suzuki Y., Matsumoto M., Nakayama KI., Hirayama A., Soga T., Kuroda S.
Trans-omic analysis reveals obesity-associated dysregulation of inter-organ metabolic cycles between the liver and skeletal muscle.
iScience, 24: 102217, 2021.
Kawamura A., Katayama Y., Kakegawa W., Ino D., Nishiyama M., Yuzaki M., Nakayama KI.
The autism-associated protein CHD8 is required for cerebellar development and motor function.
Cell Rep., 35: 108932, 2021.
Ichihara K., Matsumoto A., Nishida H., Kito Y., Shimizu H., Shichino Y., Iwasaki S., Imami K., Ishihama Y., Nakayama KI.
Combinatorial analysis of translation dynamics reveals eIF2 dependence of translation initiation at near-cognate codons.
Nucleic Acids Res., 49: 7298-317, 2021.
Nita A., Matsumoto A., Tang R., Shiraishi C., Ichihara K., Saito D., Suyama M., Yasuda T., Tsuji G., Furue M., Katayama B., Ozawa T., Murata T., Dainichi T., Kabashima K., Hatano A., Matsumoto M., Nakayama KI.
A ubiquitin-like protein encoded by the “noncoding” RNA TINCR promotes keratinocyte proliferation and wound healing.
PLOS Genet., 17: e1009686, 2021.
Matsuzaki F., Uda S., Yamauchi Y., Matsumoto M., Soga T., Maehara K., Ohkawa Y., Nakayama KI., Kuroda S., Kubota H.
An extensive and dynamic trans-omic network illustrating prominent regulatory mechanisms in response to insulin in the liver.
Cell Rep., 36: 109569, 2021.
Cherepanov SM., Gerasimenko M., Yuhi T., Furuhara K., Tsuji C., Yokoyama S., Nakayama KI., Nishiyama M., Higashida H.
Oxytocin ameliorates impaired social behavior in a Chd8 haploinsufficiency mouse model of autism.
BMC Neurosci., 22: 32, 2021.
Maimaiti M., Sakamoto S., Sugiura M., Kanesaka M., Fujimoto A., Matsusaka K., Xu M., Ando K., Saito S., Wakai K., Imamura Y., Nakayama KI., Kanai Y., Kaneda A., Ikehara Y., Ikeda JI., Anzai N., Ichikawa T.
The heavy chain of 4F2 antigen promote prostate cancer progression via SKP-2.
Sci. Rep., 11: 11478, 2021.
2020
Matsuhisa K., Saito A., Cai L., Kaneko M., Okamoto T., Sakaue F., Asada R., Urano F., Yanagida K., Okochi M., Kudo Y., Matsumoto M., Nakayama KI., Imaizumi K.
Production of BBF2H7-derived small peptide fragments via endoplasmic reticulum stress-dependent regulated intramembrane proteolysis.
FASEB J., 34: 865-80, 2020.
Oshikawa K., Matsumoto M., Kodama M., Shimizu H., Nakayama KI.
A fail-safe system to prevent oncogenesis by senescence is targeted by SV40 small T antigen.
Oncogene, 39: 2170-86, 2020.
Laukoter S., Beattie R., Pauler FM., Amberg N., Nakayama KI., Hippenmeyer S.
Imprinted cdkn1c genomic locus cell-autonomously promotes cell survival in cerebral cortex development.
Nature Commun., 11: 195, 2020.
Masuda T., Noda Mi., Kogawa T., Kitagawa D., Hayashi N., Jomori T., Nakanishi Y., Nakayama KI., Ohno S., Mimori K.
Phase I dose-escalation trial to repurpose propagermanium, an oral CCL2 Inhibitor, in patients with breast cancer.
Cancer Sci., 111: 924-31, 2020.
Kodama M., Oshikawa K., Shimizu H., Yoshioka S., Takahashi M., Izumi Y., Bamba T., Tateishi C., Tomonaga T., Matsumoto M., Nakayama KI.
A shift in glutamine nitrogen metabolism contributes to malignant progression of cancer.
Nature Commun., 11: 1320, 2020.
Masuda T., Tsuruda Y., Matsumoto Y., Uchida H., Nakayama KI., Mimori K.
Drug repositioning in cancer: the current situation in Japan.
Cancer Sci., 111: 1039-46, 2020.
Wakabayashi Y., Tamura Y., Kouzaki K., Kikuchi N., Hiranuma K., Menuki K., Tajima T., Yamanaka Y., Sakai A., Nakayama KI., Kawamoto T., Kitagawa K., Nakazato K.
Acetaldehyde dehydrogenase 2 deficiency increases mitochondrial ROS emission and induces mitochondrial protease Omi/HtrA2 in skeletal muscle.
Am. J. Physiol.-Regul. Integr. Comp. Physiol., 318: R677-90, 2020.
Takahashi H., Ranjan A., Chen S., Suzuki H., Shibata M., Hirose T., Hirose H., Sasaki K., Abe R., Chen K., He Y., Zhang Y., Takigawa I., Tsukiyama T., Watanabe M., Fujii S., Iida M., Yamamoto J., Yamaguchi Y., Suzuki Y., Matsumoto M., Nakayama KI., Washburn MP., Saraf A., Florens L., Sato S., Tomomori-Sato C., Conaway RC., Conaway JW., Hatakeyama S.
The role of Mediator and Little Elongation Complex in transcription termination.
Nature Commun., 11: 1063, 2020.
Shimizu H., Nakayama KI.
Artificial intelligence in oncology.
Cancer Sci., 111: 1452-60, 2020.
Yumimoto K., Nakayama KI.
Recent insight into the role of FBXW7 as a tumor suppressor.
Semin. Cancer Biol., 67: 1-15, 2020.
Kawamura A., Katayama Y., Nishiyama M., Shoji H., Tokuoka K., Ueta Y., Miyata M., Isa T., Miyakawa T., Hayashi-Takagi A., Nakayama KI.
Oligodendrocyte dysfunction due to Chd8 mutation gives rise to behavioral deficits in mice.
Hum. Mol. Genet., 29: 1274-91, 2020.
Kito Y., Matsumoto M., Hatano A., Takami T., Oshikawa K., Matsumoto A., Nakayama KI.
Cell cycle–dependent localization of the proteasome to chromatin.
Sci. Rep., 10: 5801, 2020.
Nakagawa T, Nakayama K, Nakayama KI.
Knockout mouse models provide insight into the biological functions of CRL1 components.
Adv. Exp. Med. Biol., 1217: 147-71, 2020.
Nakagawa T., Hattori S., Nobuta R., Kimura R., Nakagawa M., Matsumoto M., Nagasawa Y., Funayama R., Miyakawa T., Inada T., Osumi N., Nakayama KI., Nakayama K.
The autism-related protein SETD5 controls neural cell proliferation through epigenetic regulation of rDNA expression.
iScience, 23: 101030, 2020.
Yamauchi Y., Nita A., Nishiyama M., Muto Y., Shimizu H., Nakatsumi H., Nakayama KI.
Skp2 contributes to cell cycle progression in trophoblast stem cells and to placental development.
Genes Cells, 25: 427-38, 2020.
Yumimoto K., Yamauchi Y., Nakayama KI.
F-Box Proteins and Cancer.
Cancers, 12: 1249, 2020.
Tsukiyama T., Juqi Z., Kim J., Ogamino S., Shino Y., Masuda T., Merenda A., Matsumoto M., Fujioka Y., Hirose T., Terai S., Takahashi H., Ishitani T., Nakayama KI., Ohba Y., Koo B-K., Hatakeyama S.
A phospho-switch controls RNF43-mediated degradation of Wnt receptors to suppress tumorigenesis.
Nature Commun., 11: 4586, 2020.
Shirane M., Wada M., Morita K., Hayashi N., Kunimatsu R., Matsumoto Y., Matsuzaki F., Nakatsumi H., Ohta K., Tamura Y., Nakayama KI.
Protrudin and PDZD8 contribute to neuronal integrity by promoting lipid extraction required for endosome maturation.
Nature Commun., 11: 4576, 2020.
Onoyama I., Nakayama S., Shimizu H., Nakayama KI.
Loss of Fbxw7 impairs development of and induces heterogeneous tumor formation in the mouse mammary gland.
Cancer Res., 80: 5515-30, 2020.
Shirane M., Shoji H., Hashimoto Y., Katagiri H., Kobayashi S., Manabe T., Miyakawa T., Nakayama KI.
Protrudin-deficient mice manifest depression-like behavior with abnormalities in activity, attention, and cued fear-conditioning.
Mol. Brain, 13: 146, 2020.
Kawamura A., Abe Y., Seki F., Katayama Y., Nishiyama M., Takata N., Tanaka KF., Okano H., Nakayama KI.
Chd8 mutation in oligodendrocytes alters microstructure and functional connectivity in the mouse brain.
Mol. Brain, 13: 160, 2020.
Kokaji T., Hatano A., Ito Y., Yugi K., Eto M., Morita K., Ohno S., Fujii M., Hironaka KI., Egami R., Terakawa A., Tsuchiya T., Ozaki H., Inoue H., Uda S., Kubota H., Suzuki Y., Ikeda K., Arita M., Matsumoto M., Nakayama KI., Hirayama A., Soga T., Kuroda S.
Transomics analysis reveals allosteric and gene regulation axes for altered hepatic glucose-responsive metabolism in obesity.
Sci. Signal., 13: eaaz1236, 2020.
Kodama M., Nakayama KI.
A second Warburg-like effect in cancer metabolism: The metabolic shift of glutamine-derived nitrogen: A shift in glutamine-derived nitrogen metabolism from glutaminolysis to de novo nucleotide biosynthesis contributes to malignant evolution of cancer.
Bioessays., 42: e2000169, 2020.
2019
Kawata K., Yugi K., Hatano A., Kokaji T., Tomizawa Y., Fujii M., Uda S., Kubota H., Matsumoto M., Nakayama KI., Kuroda S.
Reconstruction of global regulatory network from signaling to cellular functions using phosphoproteomic data.
Genes Cells, 24: 82-93, 2019.
Shimizu H., Takeishi S., Nakatsumi H., Nakayama KI.
Prevention of cancer dormancy by Fbxw7 ablation eradicates disseminated tumor cells.
JCI Insight, 4: pii-125138, 2019.
Muto Y., Moroishi T., Ichihara K., Nishiyama M., Shimizu H., Eguchi H., Moriya K., Koike K., Mimori K., Mori M., Katayama Y., Nakayama KI.
Disruption of FBXL5-mediated cellular iron homeostasis promotes liver carcinogenesis.
J. Exp. Med., 216: 950-65, 2019.
Sugiyama S., Yumimoto K., Inoue I., Nakayama KI.
SCF(Fbxw7) ubiquitylates KLF7 for degradation in a manner dependent on GSK-3–mediated phosphorylation.
Genes Cells, 24: 354-65, 2019.
Yumimoto K., Sugiyama S., Mimori K., Nakayama KI.
The potentials of CCL2-CCR2 blockers including propagermanium as anticancer agents.
Cancer Sci., 110: 2090-9, 2019.
Shimizu H., Nakayama KI.
A 23 gene–based molecular prognostic score precisely predicts overall survival of breast cancer patients.
EBioMedicine, 46: 150-9, 2019.
Honda H., Matsumoto M., Shijo M., Hamasaki H., Sadashima S., Suzuki SO., Aishima S., Kai K., Nakayama KI., Sasagasako N., Iwaki T.
Frequent detection of pituitary-derived PrPres in human prion diseases.
J. Neuropathol. Exp. Neurol., 78: 922-9, 2019.
Takii R., Fujimoto M., Matsumoto M., Srivastava P., Katiyar A., Nakayama KI., Nakai A.
HSF1-SGO2 complex promotes the heat shock response by recruiting RNA polymerase II.
EMBO J., 38: e102566, 2019.
2018
Hagihara H., Catts VS., Katayama Y., Shoji H., Takagi T., Huang FL., Nakao A., Mori Y., Huang KP., Ishii S., Graef IA., Nakayama KI., Shannon Weickert C., Miyakawa T.
Decreased brain pH as a shared endophenotype of psychiatric disorders.
Neuropsychopharmacology, 43: 459-68, 2018.
Sakai E., Nakayama M., Oshima H., Kouyama Y., Niida A., Fujii S., Ochiai A., Nakayama KI., Mimori K., Suzuki Y., Hong CP., Ock CY., Kim SJ., Oshima M.
Combined mutation of Apc, Kras and Tgfbr2 effectively drives metastasis of intestinal cancer.
Cancer Res., 78: 1334-46, 2018.
Mikamo M., Kitagawa K., Sakai S., Uchida C., Ohhata T., Nishimoto K., Niida H., Suzuki S., Nakayama KI., Inui N., Suda T., Kitagawa M.
Inhibiting Skp2 E3 Ligase Suppresses Bleomycin-Induced Pulmonary Fibrosis.
J. Mol. Sci., 19: pii: E474, 2018.
Nakayama S., Yumimoto K., Kawamura A., Nakayama KI.
Degradation of the endoplasmic reticulum-anchored transcription factor MyRF by the ubiquitin ligase SCFFbxw7 in a manner dependent on the kinase GSK-3.
J. Biol. Chem., 293: 5705-14, 2018.
Morita M., Sato T., Nomura M., Sakamoto Y., Inoue Y., Tanaka R., Ito S., Kurosawa K., Yamaguchi K., Sugiura Y., Takizaki H., Yamashita Y., Katakura R., Sato I., Kawai M., Okada Y., Watanabe H., Kondoh G., Matsumoto S., Kishimoto A., Obata M., Matsumoto M., Fukuhara T., Motohashi H., Suematsu M., Komatsu M., Nakayama KI., Watanabe T., Soga T., Shima H., Maemondo M., Tanuma N.
Pkm1 confers metabolic advantages and promotes cell-autonomous tumor cell growth.
Cancer Cell, 33: 355-67, 2018.
Matsumoto M., Nakayama KI.
The promise of targeted proteomics for quantitative network biology.
Curr. Opin. Biotechnol., 54: 88-97, 2018.
Hashimoto Y., Shirane M., Nakayama KI.
TMEM55B contributes to lysosomal homeostasis and amino acid–induced mTORC1 activation.
Genes Cells, 23: 418-34, 2018.
Kita Y., Katayama Y., Shiraishi T., Oka T., Sato T., Suyama M., Ohkawa Y., Miyata K., Oike Y., Shirane M., Nishiyama M., Nakayama KI.
The autism-related protein CHD8 cooperates with C/EBPβ to regulate adipogenesis.
Cell Rep., 23: 1988-2000, 2018.
Matsumoto A., Nakayama KI.
Hidden peptides encoded by putative noncoding RNAs.
Cell Struct. Funct., 43: 75-83, 2018.
Hosokawa H., Ungerbäck J., Wang X., Matsumoto M., Nakayama KI., Tanaka T., Rothenberg EV.
Transcription factor PU.1 represses and activates gene expression in early T cells by redirecting partner transcription factor binding.
Immunity, 48: 1119-34, 2018.
Nakatsumi H., Oka T., Higa T., Shirane M., Nakayama KI.
Nuclear-cytoplasmic shuttling protein PP2AB56 contributes to mTORC1-dependent dephosphorylation of FOXK1.
Genes Cells, 23: 599-605, 2018.
Watanabe S., Fujiyama H., Takafuji T., Kayama K., Matsumoto M., Nakayama KI., Yoshida K., Sugimoto N., Fujita M.
Glutamate-rich WD40 repeat containing 1 regulates ribosomal protein L23 levels via the ubiquitin-proteasome system.
J. Cell Sci., 131: jcs213009, 2018.
Kawata K., Hatano A., Yugi K., Sano T., Fujii M., Tomizawa Y., Kokaji T., Tanaka KY., Uda S., Suzuki Y., Matsumoto M., Nakayama KI., Saitoh K., Kato K., Ueno A., Ohishi M., Hirayama A., Soga T., Kuroda S.
Trans-omic analysis reveals selective responses to induced and basal insulin across signaling, transcriptional, and metabolic networks.
iScience, 7: 212-29, 2018.
Ito A., Jamal M., Ameno K., Tanaka N., Takakura A., Kawamoto T., Kitagawa K., Nakayama KI., Matsumoto A., Miki T., Kinoshita H.
Acetaldehyde administration induces salsolinol formation in vivo in the dorsal striatum of Aldh2-knockout and C57BL/6N mice.
Neurosci. Lett., 685: 50-4, 2018.
Hosokawa H., Romero-Wolf M., Yui MA., Ungerbäck J., Quiloan MJG., Matsumoto M., Nakayama KI., Tanaka T., Rothenberg EV.
Bcl11b sets pro-T cell fate by site-specific cofactor recruitment and by repressing Id2 and Zbtb16.
Nature Immunol., 19: 1427-40, 2018.
Sumitomo A., Saka A., Ueta K., Horike K., Hirai K., Gamo NJ., Hikida T., Nakayama KI., Sawa A., Sakurai T., Tomoda T.
Methylphenidate and guanfacine ameliorate ADHD-like phenotypes in Fez1-deficient mice.
Mol. Neuropsychiatry, 3: 223-33, 2018.
Hui K., Katayama Y., Nakayama KI., Nomura J., Sakurai T.
Characterizing vulnerable brain areas and circuits in mouse models of autism: Towards understanding pathogenesis and new therapeutic approaches.
Neurosci. Biobehav. Rev., [Epub ahead of print].
Abe Y., Honsho M., Itoh R., Kawaguchi R., Fujitani M., Fujiwara K., Hirokane M., Matsuzaki T., Nakayama K., Ohgi R., Marutani T., Nakayama KI., Yamashita T., Fujiki Y.
Peroxisome biogenesis deficiency attenuates the BDNF-TrkB pathway-mediated development of the cerebellum.
Life Sci. Alliance, 1: e201800062, 2018.
Matsumoto J., Takada S., Kinugawa S., Furihata T., Nambu H., Kakutani N., Tsuda M., Fukushima A., Yokota T., Tanaka S., Takahashi H., Watanabe M., Hatakeyama S., Matsumoto M., Nakayama KI., Otsuka Y., Sabe H., Tsutsui H., Anzai T.
Brain-derived neurotrophic factor improves limited exercise capacity in mice with heart failure.
Circulation, 138: 2064-6, 2018.
2017
Kayama K., Watanabe S., Takafuji T., Tsuji T., Hironaka K., Matsumoto M., Nakayama KI., Enari M., Kohno T., Shiraishi K., Kiyono T., Yoshida K., Sugimoto N., Fujita M.
GRWD1 negatively regulates p53 via the RPL11-MDM2 pathway and promotes tumorigenesis.
EMBO Rep., 18: 123-37, 2017.
Matsumoto M., Matsuzaki F., Oshikawa K., Goshima N., Mori M., Kawamura Y., Ogawa K., Fukuda E., Nakatsumi H., Natsume T., Fukui K., Horimoto K., Nagashima T., Funayama R., Nakayama K. & Nakayama KI.
A large-scale targeted proteomics assay resource based on an in vitro human proteome.
Nature Methods, 14: 251-8, 2017.
Matsumoto A., Pasut A., Matsumoto M., Yamashita R., Fung J., Saghatelian A., Nakayama KI., Clohessy JG., Monteleone E., Pandolfi PP.
mTORC1 and muscle regeneration are regulated by the LINC00961 encoded SPAR polypeptide.
Nature, 541: 228-32, 2017.
Ohnishi T., Shirane M., Nakayama KI.
SRRM4-dependent neuron-specific alternative splicing of protrudin transcripts regulates neurite outgrowth.
Sci. Rep., 7: 41130, 2017.
Yamauchi T., Nishiyama M., Moroishi T., Kawamura A., Nakayama KI.
FBXL5 inactivation in mouse brain induces aberrant proliferation of neural stem-progenitor cells.
Mol. Cell. Biol., 37: e00470-16, 2017.
Yachie N., Robotic Biology Consortium (incl. Matsumoto M., Nakayama KI.), Natsume T.
Robotic crowd biology with Maholo LabDroids.
Nature Biotechnol., 35: 310-2, 2017.
Zhang S., Chen Q., Liu Q., Li Y., Sun X., Hong L., Ji S., Liu C., Geng J., Zhang W., Lu Z., Yin ZY., Zeng Y., Lin KH., Wu Q., Li Q., Nakayama K., Nakayama KI., Deng X., Johnson RL., Zhu L., Gao D., Chen L., Zhou D.
Hippo signaling suppresses cell ploidy and tumorigenesis through Skp2.
Cancer Cell, 31: 669-84, 2017.
Muto Y., Nishiyama M., Nita A., Moroishi T., Nakayama KI.
Essential role of FBXL5-mediated cellular iron homeostasis in maintenance of hematopoietic stem cells.
Nature Commun., 8: 16114, 2017.
Yaguchi H., Yabe I., Takahashi H., Watanabe M., Nomura T., Kano T., Matsumoto M., Nakayama KI., Watanabe M., Hatakeyama S.
Sez6l2 regulates phosphorylation of ADD and neuritogenesis.
Biochem. Biophys. Res. Commun., 494: 234-41, 2017.
Fukushima H., Shimizu K., Watahiki A., Hoshikawa S., Kosho T., Oba D., Sakano S., Arakaki M., Yamada A., Nagashima K., Okabe K., Fukumoto S., Jimi E., Bigas A., Nakayama KI., Nakayama K., Aoki Y., Wei W., Inuzuka H.
NOTCH2 Hajdu-Cheney mutations escape SCFFBW7-dependent proteolysis to promote osteoporosis.
Mol. Cell, 68: 645-58.e5., 2017.
Yonehara R., Nada S., Nakai T., Nakai M., Kitamura A., Ogawa A., Nakatsumi H., Nakayama KI., Li S., Standley DM., Yamashita E., Nakagawa A., Okada M.
Structural basis for the assembly of the Ragulator-Rag GTPase complex.
Nature Commun., 8: 1625, 2017.
Nakatsumi H., Matsumoto M., Nakayama KI.
Noncanonical pathway for regulation of CCL2 expression by an mTORC1-FOXK1 axis promotes recruitment of tumor-associated macrophages.
Cell Rep., 21: 2471-86, 2017.
2016
Inoue D., Matsumoto M., Nagase R., Saika M., Fujino T., Nakayama KI., Kitamura T.
Truncation mutants of ASXL1 observed in myeloid malignancies are expressed at detectable protein levels.
Exp. Hematol., 44: 172-6, 2016.
Fujieda Y., Amengual O., Matsumoto M., Kuroki K., Takahashi H., Kono M., Kurita T., Otomo K., Kato M., Oku K., Bohgaki T., Horita T., Yasuda S., Maenaka K., Hatakeyama S., Nakayama KI., Atsumi T.
Ribophorin II is involved in the tissue factor expression mediated by phosphatidylserine-dependent antiprothrombin antibody on monocytes.
Rheumatology, 55: 1117-26, 2016.
Nita A., Nishiyama M., Muto Y., Nakayama KI.
FBXL12 regulates T cell differentiation in a cell-autonomous manner.
Genes Cells, 5: 517-24, 2016.
Tanaka M., Shiota M., Nakao T., Uemura R., Nishi S., Ohkawa Y., Matsumoto M., Yamaguchi M., Osada-Oka M., Inagaki A., Takahashi K., Nakayama KI., Gi M., Izumi Y., Miura K., Iwao H.
Identification of low-abundance proteins in serum via the isolation of HSP72 complexes.
J Proteomics, 136: 214-21, 2016.
Hosokawa H., Tanaka T., Endo Y., Kato M., Shinoda K., Suzuki A., Motohashi S., Matsumoto M., Nakayama KI., Nakayama T.
Akt1-mediated Gata3 phosphorylation controls the repression of IFNγ in memory-type Th2 cells.
Nature Commun., 7: 11289, 2016.
Takeishi S., Nakayama KI.
To wake up cancer stem cells, or to let them sleep, that is the question.
Cancer Sci., 107: 875-81, 2016.
Duquesnes N., Callot C., Jeannot P., Daburon V., Nakayama KI., Manenti S., Davy A., Besson A.
p57Kip2 knock-in mouse reveals CDK-independent contribution in the development of Beckwith–Wiedemann syndrome.
J. Pathol., 239: 250-61, 2016.
Kitade S., Onoyama I., Kobayashi H., Yagi H., Yoshida S., Kato M., Tsunematsu R., Asanoma K., Sonoda K., Wake N., Hata K., Nakayama KI., Kato K.
FBXW7 is involved in the acquisition of the malignant phenotype in epithelial ovarian tumors.
Cancer Sci., 107: 1399-405, 2016.
Katayama Y., Nishiyama M., Shoji H., Ohkawa Y., Kawamura A., Sato T., Suyama M., Takumi T., Miyakawa T., Nakayama KI.
CHD8 haploinsufficiency results in autistic-like phenotypes in mice.
Nature, 537: 675-9, 2016.
Hatano A., Matsumoto M., Nakayama KI.
Phosphoproteomics analyses show subnetwork systems in T-cell receptor signaling.
Genes Cells, 21: 1095-112, 2016.
Mizushima W., Takahashi H., Watanabe M., Kinugawa S., Matsushima S., Takada S., Yokota T., Furihata T., Matsumoto J., Tsuda M., Chiba I., Nagashima S., Yanagi S., Matsumoto M., Nakayama KI., Tsutsui H., Hatakeyama S.
The novel heart-specific RING finger protein 207 is involved in energy metabolism in cardiomyocytes.
J. Mol. Cell. Cardiol., 100: 43-53, 2016.
2015
Lu W., Liu S., Li B., Xie Y., Adhiambo C., Yang Q., Nakayama KI., Matusik R., Chen Z.
SKP2 inactivation suppresses prostate tumorigenesis by enhancing JARID1B ubiquitination for H3K4me3 reduction.
Oncotarget, 6: 771-88, 2015.
Yumimoto K., Akiyoshi S., Ueo H., Sagara Y., Onoyama I., Ueo H., Ohno S., Mori M., Mimori K., Nakayama KI.
F-box protein FBXW7 inhibits cancer metastasis in a non-cell-autonomous manner.
J. Clin. Invest., 125: 621-35, 2015.
Nakajima T., Kitagawa K., Ohhata T., Sakai S., Uchida C., Shibata K., Minegishi N., Yumimoto K., Nakayama KI., Masumoto K., Katou F., Niida H., Kitagawa M.
Regulation of GATA binding protein 2 levels via ubiquitin-dependent degradation by Fbw7: involvement of cyclin B-cyclin-dependent kinase 1-mediated phosphorylation of Thr-176 in GATA binding protein 2.
J. Biol. Chem., 290: 10368-81, 2015.
Yumimoto K., Nakayama KI.
Fbxw7 suppresses cancer metastasis by inhibiting niche formation.
OncoImmunology, 4: e1022308, 2015.
Furutachi S., Miya H., Watanabe T., Kawai H., Yamasaki N., Harada Y., Imayoshi I., Nelson M., Nakayama KI., Hirabayashi Y., Gotoh Y.
Slowly dividing neural progenitors are an embryonic origin of adult neural stem cells.
Nature Neurosci., 18: 657-65, 2015.
Hosokawa H., Kato M., Tohyama H., Tamaki Y., Endo Y., Kimura MY., Tumes DJ., Motohashi S., Matsumoto M., Nakayama KI., Tanaka T., Nakayama T.
Methylation of Gata3 at Arg261 regulates transactivation of the Il5 gene in T helper 2 cells.
J. Biol. Chem., 290: 13095-103, 2015.
Watanabe K., Yumimoto K., Nakayama KI.
FBXO21 mediates the ubiquitylation and proteasomal degradation of EID1.
Genes Cells, 20: 667-74, 2015.
Kojima T., Yamada T., Akaishi R., Furuta I., Saitoh T., Nakabayashi K., Nakayama KI., Nakayama K., Akira S., Minakami H.
Role of the Atg9a gene in intrauterine growth and survival of fetal mice.
Reprod. Biol., 15: 131-8, 2015.
Nishiyama M., Nita A., Yumimoto K., Nakayama KI.
FBXL12-mediated degradation of ALDH3 is essential for trophoblast differentiation during placental development.
Stem Cells, 33: 3327-40, 2015.
Tane S., Okayama H., Ikenishi A., Amemiya Y., Nakayama KI., Takeuchi T.
Two inhibitory systems and CKIs regulate cell cycle exit of mammalian cardiomyocytes after birth.
Biochem. Biophys. Res. Commun., 466: 147-54, 2015.
Tsukada Y., Akiyama T., Nakayama KI.
Maternal TET3 is dispensable for embryonic development but is required for neonatal growth.
Sci. Rep., 5: 15876, 2015.
Matsunuma R., Niida H., Ohhata T., Kitagawa K., Sakai S., Uchida C., Shiotani B., Matsumoto M., Nakayama KI., Ogura H., Shiiya N., Kitagawa M.
UV damage-induced phosphorylation of HBO1 triggers CRL4DDB2-mediated degradation to regulate cell proliferation.
Mol. Cell. Biol., 36: 394-406, 2015.
Maehara K., Harada A., Sato Y., Matsumoto M., Nakayama KI., Kimura H., Ohkawa Y.
Tissue-specific expression of histone H3 variants diversified after species separation.
Epigenetics Chromatin, 8: 35, 2015.
2014
Kotoshiba S., Gopinathan L., Pfeiffenberger E., Rahim A., Vardy LA., Nakayama K., Nakayama KI., Kaldis P.
p27 is regulated independently of Skp2 in the absence of Cdk2.
Biochim Biophys Acta., 1843: 436-45, 2014.
Tane S., Ikenishi A., Okayama H., Iwamoto N., Nakayama KI., Takeuchi T.
CDK inhibitors, p21Cip1 and p27Kip1, participate in cell cycle exit of mammalian cardiomyocytes.
Biochem. Biophys. Res. Commun., 443: 1105-9, 2014.
Lu Z., Bauzon F., Fu H., Cui J., Zhao H., Nakayama K., Nakayama KI., Zhu L.
Skp2 suppresses apoptosis in Rb1 deficient tumors by limiting E2F1 activity.
Nature Commun., 5: 3463, 2014.
Shirane M., Nakayama KI.
Mitochondria: FKBP38 and mitochondrial degradation.
Int. J. Biochem. Cell Biol., 51C: 19-22, 2014.
*Matsumoto A., *Takeishi S., Nakayama KI. (*Co-first authors)p57 regulates T-cell development and prevents lymphomagenesis by balancing p53 activity and pre-TCR signaling.
Blood, 123: 3429-39, 2014.
*Hashimoto Y., *Shirane M., Matsuzaki F., Saita S., Ohnishi T., Nakayama KI. (*Co-first authors)Protrudin regulates endoplasmic reticulum morphology and function associated with the pathogenesis of hereditary spastic paraplegia.
J. Biol. Chem., 289: 12946-61., 2014.
Takeishi S., Nakayama KI.
Role of Fbxw7 in the maintenance of normal stem cells and cancer-initiating cells.
Br. J. Cancer, 111: 1054-9, 2014.
Moroishi T., Yamauchi T., Nishiyama M., Nakayama KI.
HERC2 targets the iron regulator FBXL5 for degradation and modulates iron metabolism.
J. Biol. Chem., 289: 16430-41, 2014.
Kanatsu-Shinohara M., Onoyama I., Nakayama KI., Shinohara T.
SCF-type ubiquitin ligase Fbxw7 negatively regulates spermatogonial stem cell self-renewal.
Proc. Natl. Acad. Sci. U.S.A., 111: 8826-31, 2014.
Kitagawa K., Shibata K., Matsumoto A., Matsumoto M., Ohhata T., Nakayama KI., Niida H., Kitagawa M.
Fbw7 targets GATA3 through CDK2-dependent proteolysis and contributes to regulation of T-cell development.
Mol. Cell. Biol., 34: 2732-44, 2014.
Hashiguchi T., Oyamada A., Sakuraba K., Shimoda K., Nakayama KI., Iwamoto Y., Yoshikai Y., Yamada H.
Tyk2-dependent bystander activation of conventional and nonconventional Th1 cell subsets contributes to innate host defense against Listeria monocytogenes infection.
J. Immunol., 192: 4739-47, 2014.
Yamauchi T., Nishiyama M., Moroishi T., Yumimoto K., Nakayama KI.
MDM2 mediates nonproteolytic polyubiquitylation of the DEAD-box RNA helicase DDX24.
Mol. Cell. Biol., 34: 3321-40, 2014.
Saita S., Shirane M., Ishitani T., Shimizu N., Nakayama KI.
Role of the ANKMY2-FKBP38 axis in regulation of the Sonic Hedgehog (Shh) signaling pathway
J. Biol. Chem., 289: 25639-54, 2014.
Adachi S., Homoto M., Tanaka R., Hioki Y., Murakami H., Suga H., Matsumoto M., Nakayama KI., Hatta T., Iemura SI., Natsume T.
ZFP36L1 and ZFP36L2 control LDLR mRNA stability via the ERK-RSK pathway.
Nucleic Acids Res., 42: 10037-49, 2014.
Yugi K., Kubota H., Toyoshima Y., Noguchi R., Kawata K., Komori Y., Uda S., Kunida K., Tomizawa Y., Funato Y., Miki H., Matsumoto M., Nakayama KI., Kashikura K., Endo K., Ikeda K., Soga T., Kuroda S.
Reconstruction of insulin signal flow from phosphoproteome and metabolome data.
Cell Rep., 8: 1171-83, 2014.
2013
Saita S., Shirane M., Nakayama KI.
Selective escape of proteins from mitochondria during mitophagy.
Nature Commun., 4: 1410, 2013.
Takeishi S., Matsumoto A., Onoyama I., Naka K., Hirao A., Nakayama KI.
Ablation of Fbxw7 eliminates leukemia-initiating cells by preventing quiescence.
Cancer Cell, 23: 347-61, 2013.
Reavie L., Buckley SM., Loizou E., Takeishi S., Aranda-Orgilles B., Ndiaye-Lobry D., Abdel-Wahab O., Ibrahim S., Nakayama KI., Aifantis I.
Regulation of c-Myc ubiquitination controls chronic myelogenous leukemia initiation and progression.
Cancer Cell, 23: 362-75, 2013.
Furutachi S., Matsumoto A., Nakayama KI., Gotoh Y.
p57 controls adult neural stem cell quiescence and modulates the pace of lifelong neurogenesis.
EMBO J., 32: 970-81, 2013.
Hirano A., Yumimoto K., Tsunematsu R., Matsumoto M., Oyama M., Kozuka-Hata H., Nakagawa T., Lanjakornsiripan D., *Nakayama KI., *Fukada Y. (*Co-corresponding authors)FBXL21 regulates oscillation of the circadian clock through ubiquitination and stabilization of cryptochromes.
Cell, 152: 1106-18, 2013.
Yamamoto A., Takeya R., Matsumoto M., Nakayama KI., Sumimoto H.
Phosphorylation of Noxo1 at threonine-341 regulates its interaction with Noxa1 and the superoxide-producing activity of Nox1.
FEBS J., 280: 5145-59, 2013.
Yumimoto K., Matsumoto M., Onoyama I., Imaizumi K., Nakayama KI.
F-box and WD repeat domain containing-7 (Fbxw7) targets endoplasmic reticulum-anchored osteogenic and chondrogenic transcriptional factors for degradation.
J. Biol. Chem., 288: 28488-502, 2013.
Khor EC., Abel T., Tickner J., Chim SM., Wang C., Cheng T., Ng B., Ng PY., Teguh DA., Kenny J., Yang X., Chen H., Nakayama KI., Nakayama K., Pavlos N., Zheng MH., Xu J.
Loss of protein kinase C-delta protects against LPS-induced osteolysis owing to an intrinsic defect in osteoclastic bone resorption.
PLoS One, 8: e70815, 2013.
Yumimoto K., Muneoka T., Tsuboi T., Nakayama KI.
Substrate binding promotes formation of the Skp1-Cul1-Fbxl3 (SCF/Fbxl3) complex.
J. Biol. Chem., 288: 32766-76, 2013.
Ohnishi T., Shirane M., Hashimoto Y., Saita S., Nakayama KI.
Identification and characterization of a neuron-specific isoform of protrudin.
Genes Cells, 19: 97-111, 2013.
Zhao H., Bauzon F., Fu H., Lu Z., Cui J., Nakayama K., Nakayama KI., Locker J., Zhu L.
Skp2 deletion unmasks a p27 safeguard that blocks tumorigenesis in the absence of pRb and p53 tumor suppressors.
Cancer Cell, 24: 645-59, 2013.
2012
Chow C., Wong N., Pagano M., Lun SW., Nakayama KI., Nakayama K., Lo KW.
Regulation of APC/C(Cdc20) activity by RASSF1A-APC/C(Cdc20) circuitry.
Oncogene, 31: 1975-87, 2012.
Oshikawa K., Matsumoto M., Oyamada K., Nakayama KI.
Proteome-wide identification of ubiquitylation sites by conjugation of engineered lysine-less ubiquitin.
J. Proteome Res., 11: 796-807, 2012.
Nishiyama M., Skoultchi AI., Nakayama KI.
Histone H1 recruitment by CHD8 is essential for suppression of the Wnt-beta-catenin signaling pathway.
Mol. Cell. Biol., 32: 501-12, 2012.
Kanie T., Onoyama I., Matsumoto A., Yamada M., Nakatsumi H., Tateishi Y., Yamamura S., Tsunematsu R., Matsumoto M., Nakayama KI.
Genetic reevaluation of the role of F-box proteins in cyclin D1 degradation.
Mol. Cell. Biol., 32: 590-605, 2012.
Ellman MB., Kim J., An HS., Kroin JS., Li X., Chen D., Yan D., Buechter DD., Nakayama KI., Mochly-Rosen D., Liu B., Qvit N., Morganand S., Im HJ.
The pathophysiological role of the PKCdelta pathway in the intervertebral disc: In vitro, ex vivo and in vivo studies.
Arthritis Rheum., 64: 1950-9, 2012.
Bargagna-Mohan P., Paranthan RR., Hamza A., Zhan CG., Lee DM., Kim KB., Lau DL., Srinivasan C., Nakayama K., Nakayama KI., Herrmann H., Mohan R.
A corneal anti-fibrotic switch identified in genetic and pharmacological deficiency of vimentin.
J. Biol. Chem., 287: 989-1006, 2012.
Chan CH., Li CF., Yang WL., Gao Y., Lee SW., Feng Z., Huang HY., Tsai KKC., Flores LG., Shao Y., Hazle JD., Yu D., Wei W., Sarbassov D., Hung MC., Nakayama KI., Lin HK.
The Skp2-SCF E3 ligase regulates Akt ubiquitination, glycolysis, Herceptin sensitivity and tumorigenesis.
Cell, 149: 1098-111, 2012.
Liu N., Matsumoto M., Kitagawa K., Kotake Y., Suzuki S., Shirasawa S., Nakayama KI., Nakanishi M., Niida H., Kitagawa M.
Chk1 phosphorylates the tumor suppressor Mig-6, regulating the activation of EGF signaling.
EMBO J., 31: 2365-77, 2012.
Kita Y., Nishiyama M., Nakayama KI.
Identification of CHD7S as a novel splicing variant of CHD7 with functions similar and antagonistic to those of the full-length CHD7L.
Genes Cells, 17: 536-47, 2012.
Ishikawa Y., Hosogane M., Okuyama R., Aoyama S., Onoyama I., Nakayama KI., Nakayama K.
Opposing functions of Fbxw7 in keratinocyte growth-differentiation and skin tumorigenesis mediated through negative regulation of c-Myc and Notch.
Oncogene, 32: 1921-32, 2012.
Suzuki S., Fukasawa H., Misaki T., Togawa A., Ohashi N., Kitagawa K., Kotake Y., Niida H., Liu N., Nakayama K., Nakayama KI., Yamamoto T., Kitagawa M.
The amelioration of renal damage in Skp2-deficient mice is canceled by p27Kip1 deficiency in Skp2-/- p27-/- mice.
PLoS One, 7: e36249, 2012.
Yumimoto K., Matsumoto M., Oyamada K., Moroishi T., Nakayama KI.
Comprehensive identification of substrates for F-box proteins by differential proteomics analysis.
J. Proteome Res., 11: 3175–85, 2012.
Yokobori T., Mimori K., Iwatsuki M., Ishii H., Tanaka F., Sato T., Toh H., Sudo T., Iwaya T., Tanaka Y., Onoyama I., Kuwano H., Nakayama KI., Mori M.
Copy number loss of FBXW7 is related to gene expression and poor prognosis in esophageal squamous cell carcinoma.
Int. J. Oncol., 41: 253-9, 2012.
Fukushima H., Matsumoto A., Inuzuka H., Zhai B., Lau AW., Wan L., Gao D., Shaik S., Yuan M., Gygi SP., Jimi E., Asara JM., Nakayama K., Nakayama KI., Wei W.
SCFFbw7 modulates the NFkB signaling pathway by targeting NFkB2 for ubiquitination and destruction.
Cell Rep., 1: 434-43, 2012.
Grim JE., Knoblaugh SE., Guthrie KA., Hagar A., Swanger J., Hespelt J., Delrow JJ., Small T., Grady WM., Nakayama KI., Clurman BE.
Fbw7 and p53 cooperatively suppress advanced and chromosomally unstable intestinal cancer.
Mol. Cell. Biol., 32: 2160-7, 2012.
Hoshi H., Hao W., Fujita Y., Funayama A., Miyauchi Y., Hashimoto K., Miyamoto K., Iwasaki R., Sato Y., Kobayashi T., Miyamoto H., Yoshida S., Mori T., Kanagawa H., Katsuyama E., Fujie A., Kitagawa K., Nakayama KI., Kawamoto T., Sano M., Fukuda K., Ohsawa I., Ohta S., Morioka H., Matsumoto M., Chiba K., Toyama Y., Miyamoto T.
Aldehyde-stress resulting from Aldh2 mutation promotes osteoporosis due to impaired osteoblastogenesis.
J. Bone Miner. Res., 27: 2015-23, 2012.
Okita Y., Matsumoto A., Yumimoto K., Isoshita R., Nakayama KI.
Increased efficiency in the generation of induced pluripotent stem cells by Fbxw7 ablation.
Genes Cells, 17: 768-77, 2012.
Matsumoto A., Nakayama KI.
Role of key regulators of the cell cycle in maintenance of hematopoietic stem cells.
BBA – Gen. Subjects, 1830: 2335-44, 2012.
Cremasco V., Decker CE., Stumpo D., Blackshear PJ., Nakayama KI., Nakayama K., Lupu TS., Graham DB., Novack DV., Faccio R.
PKCδ deficiency perturbs bone homeostasis by selective uncoupling of cathepsin K secretion and ruffled border formation in osteoclasts.
J. Bone Miner. Res., 27: 2452-63, 2012.
Tateishi Y., Matsumoto A., Kanie T., Hara E., Nakayama K., Nakayama KI.
Development of mice without Cip/Kip CDK inhibitors.
Biochem. Biophys. Res. Commun., 427: 285-92, 2012.
Okita Y., Nakayama KI.
UPS delivers pluripotency.
Cell Stem Cell, 11: 728-30, 2012.
Narumi R., Murakami T., Kuga T., Adachi J., Shiromizu T., Muraoka S., Kume H., Kodera Y., Matsumoto M., Nakayama KI., Miyamoto Y., Ishitobi M., Inaji H., Kato K., Tomonaga T.
A strategy for large-scale phosphoproteomics and SRM-based validation of human breast cancer tissue samples.
J. Proteome Res., 11: 5311-22, 2012.
2011
Bohgaki M., Matsumoto M., Atsumi T., Kondo T., Yasuda S., Horita T., Nakayama KI., Okumura F., Hatakeyama S., Koike T.
Plasma gelsolin facilitates interaction between β2 glycoprotein I and α5β1 integrin.
J. Cell. Mol. Med., 15: 141-51, 2011.
Onoyama I., Suzuki A., Matsumoto A., Tomita K., Katagiri H., Oike Y., Nakayama K., Nakayama KI.
Fbxw7 regulates lipid metabolism and cell fate decisions in the mouse liver.
J. Clin. Invest., 121: 342-54, 2011.
Inuzuka H., Shaik S., Onoyama I., Tseng A., Gao D., Maser R., Zhai B., Gutierrez A., Wan L., Lau A., Xiao Y., Christie A., Aster J., Settleman J., Kung AL., Gygi SP., Look T., Nakayama KI., DePinho RA., Wei W.
SCFFbw7 regulates cellular apoptosis by targeting the Mcl-1 oncoprotein for ubiquitination and destruction.
Nature, 471: 104-9, 2011.
Iriuchishima H., Takubo K., Matsuoka S., Onoyama I., Nakayama KI., Nojima Y., Suda T.
Ex vivo maintenance of hematopoietic stem cells by quiescence induction through Fbxw7α overexpression.
Blood, 117: 2373-7, 2011.
Matsumoto A., Tateishi Y., Onoyama I., Okita Y., Nakayama K., Nakayama KI.
Fbxw7β resides in the endoplasmic reticulum membrane and protects cells from oxidative stress.
Cancer Sci., 102: 749-55, 2011.
Katagiri K., Ueda Y., Tomiyama T., Yasuda K., Toda Y., Ikehara S., Nakayama KI., Kinashi T.
Deficiency of Rap1-GTP binding protein RAPL causes lymphoproliferative disorders through the mislocalization of cyclin-dependent kinase inhibitor p27kip1.
Immunity, 34: 24-38, 2011.
Tachiyama R., Ishikawa D., Matsumoto M., Nakayama KI., Yoshimori T., Yokota S., Himeno M., Tanaka Y., Fujita H.
Proteome of ubiquitin/MVB-Pathway: Possible involvement of iron-induced ubiquitylation of transferrin receptor in lysosomal degradation.
Genes Cells, 16: 448-66, 2011.
Lu C., Huang X., Zhang X., Roensch K., Cao Q., Nakayama KI., Blazar BR., Zeng Y., Zhou X.
MiR-221 and miR-155 regulate human dendritic cell development, apoptosis and IL-12 production through targeting of p27kip1, KPC1 and SOCS-1.
Blood, 117: 4293-303, 2011.
Sistrunk C., Macias E., Nakayama KI., Kim Y., Rodriguez-Puebla ML.
Skp2 is necessary for Myc-induced keratinocyte proliferation but dispensable for Myc oncogenic activity in the oral epithelium.
Am. J. Pathol., 178: 2470-7, 2011.
Wu H., Pomeroy SL., Ferreira M., Teider N., Mariani J., Nakayama KI., Hatakeyama S., Tron VA., Saltibus LF., Spyracopoulos L., Leng RP.
UBE4B promotes Hdm2-mediated degradation of the tumor suppressor p53.
Nature Med., 17: 347-55, 2011.
Matsumoto A., Onoyama I., Sunabori T., Kageyama R., Okano H., Nakayama KI.
Fbxw7-dependent degradation of Notch is required for control of stemness and neuronal-glial differentiation in neural stem cells.
J. Biol. Chem., 286: 13754-64, 2011.
Yu Z., Ono C., Kim HB., Komatsu H., Tanabe Y., Sakae N., Nakayama KI., Matsuoka H., Sora I., Bunney WE., Tomita H.
Four mood stabilizers commonly induce FEZ1 expression in human astrocytes.
Bipolar Disord., 13: 486-99, 2011.
Matsumoto A., Takeishi S., Kanie T., Susaki E., Onoyama I., Tateishi Y., Nakayama K., Nakayama KI.
p57 is required for quiescence and maintenance of adult hematopoietic stem cells.
Cell Stem Cell, 9: 262-71, 2011.
Moroishi T., Nishiyama M., Takeda Y., Iwai K., Nakayama KI.
The FBXL5-IRP2 axis is integral to control of iron metabolism in vivo.
Cell Metab., 14: 339-51, 2011.
Matsumoto A., Susaki E., Onoyama I., Nakayama K., Hoshino M., Nakayama KI.
Deregulation of the p57-E2F1-p53 axis results in nonobstructive hydrocephalus and cerebellar malformation in mice.
Mol. Cell. Biol., 31: 4176-92, 2011.
Okumura F., Okumura AJ., Matsumoto M., Nakayama KI., Hatakeyama S.
TRIM8 regulates Nanog via Hsp90β-medicated nuclear translocation of STAT3 in embryonic stem cells.
Biochim. Biophys. Acta, 1813: 1784-92, 2011.
Fuster JJ., Gonzalez-Navarro H., Vinue A., Molina P., Andres-Manzano MJ., Nakayama KI., Nakayama K., Diez-Juan A., Bernad A., Rodriguez C., Martinez-Gonzalez J., Andres V.
Deficient p27 phosphorylation at serine 10 increases macrophage foam cell formation and aggravates atherosclerosis through a proliferation-independent mechanism.
Arterioscler. Thromb. Vasc. Biol., 31: 2455-63, 2011.
Fotovati A., Abu-Ali S., Nakayama K., Nakayama KI.
Impaired ovarian development and reduced fertility in female mice deficient in Skp2.
J. Anat., 218: 668-77, 2011.
Zou P., Yoshihara H., Hosokawa K., Tai I., Shinmyozu K., Tsukahara F., Maru Y., Nakayama K., Nakayama KI., Suda T.
p57(Kip2) and p27(Kip1) cooperate to maintain hematopoietic stem cell quiescence through interactions with Hsc70.
Cell Stem Cell, 9: 247-61, 2011.
Inoue S., Matsushita T., Tomokiyo Y., Matsumoto M., Nakayama KI., Kinoshita T., Shimazaki K.
Functional analyses of the activation loop of phototropin2 in Arabidopsis.
Plant Physiol., 156: 117-28, 2011.
Matsuzaki F., Shirane M., Matsumoto M., Nakayama KI.
Protrudin serves as an adaptor molecule that connects KIF5 and its cargoes in vesicular transport during process formation.
Mol. Biol. Cell, 22: 4602-20, 2011.
2010
Wang H., Bauzon F., Ji P., Xu X., Sun D., Locker J., Sellers RS., Nakayama K., Nakayama KI., Cobrinik D., Zhu L.
Skp2 is required for survival of aberrantly proliferating Rb1-deficient cells and for tumorigenesis in Rb1(+/-) mice.
Nature Genet., 42: 83-8, 2010.
Tada H., Okano HJ., Takagi H., Shibata S., Yao I., Matsumoto M., Saiga T., Nakayama KI., Kashima H., Takahashi T., Setou M., Okano H.
Fbxo45, a novel ubiquitin ligase, regulates synaptic activity.
J. Biol. Chem., 285: 3840-9, 2010.
Masuda K., Ishikawa Y., Onoyama I., Unno M., de Alboran I. M., Nakayama KI., Nakayama K.
Complex regulation of cell cycle inhibitors by Fbxw7 in mouse embryonic fibroblasts.
Oncogene, 29: 1798-809, 2010.
Iwatsuki M., Mimori K., Ishii H., Yokobori T., Takatsuno Y., Sato T., Toh H., Onoyama I., Nakayama KI., Baba H., Mori M.
Loss of FBXW7, a cell cycle regulating gene, in colorectal cancer: Clinical significance.
Int. J. Cancer, 126: 1828-37, 2010.
Tsukada Y., Ishitani T., Nakayama KI.
KDM7 is a dual demethylase for histone H3 lysines 9 and 27 and functions in brain development.
Genes Dev., 24: 432-7, 2010.
Tanaka S., Wakeyama H., Akiyama T., Takahashi K., Amano H., Nakayama KI., Nakamura K.
Regulation of osteoclast apoptosis by bcl-2 family protein bim and caspase-3.
Adv. Exp. Med. Biol., 658: 111-6, 2010.
Fujii M., Kanematsu T., Ishibashi H., Fukami K., Takenawa T., Nakayama KI., Moss SJ., Nabekura J., Hirata M.
Phospholipase C-related but catalytically inactive protein is required for insulin-induced cell surface expression of {gamma}-aminobutyric acid type A receptors.
J. Biol. Chem., 285: 4837-46, 2010.
Lin HK., Chen Z., Wang G., Nardella C., Lee SW., Chan CH., Yang WL., Wang J., Egia A., Nakayama KI., Cordon-Cardo C., Teruya-Feldstein J., Pandolfi PP.
Skp2 targeting suppresses tumourigenesis through p19Arf/p53-independent cellular senescence.
Nature, 464: 374-9, 2010.
Susaki E., Kaneko-Oshikawa C., Miyata K., Tabata M., Yamada T., Oike Y., Katagiri H., Nakayama KI.
Increased E4 activity in mice leads to ubiquitin-containing aggregates and degeneration of hypothalamic neurons resulting in obesity.
J. Biol. Chem., 285: 15538-47, 2010.
Chan CH., Lee SW., Li CF., Wang J., Yang WL., Wu1 CY., Wu J., Nakayama KI., Kang HY., Huang HY., Hung MC., Pandolfi PP., Lin HK.
Deciphering the transcription complex critical for RhoA gene expression and cancer metastasis.
Nature Cell Biol., 12: 457-67, 2010.
Old JB., Kratzat S., Hoellein A., Graf S., Nilsson JA., Nilsson L., Nakayama KI., Peschel C., Cleveland JL., Keller UB.
Skp2 Directs Myc-Mediated Suppression of p27Kip1 yet Has Modest Effects on Myc-Driven Lymphomagenesis.
Mol. Cancer Res., 8: 353-62, 2010.
Ma H., Byra EA., Yu L., Hu N., Kitagawa K., Nakayama KI., Kawamoto T., Ren J.
Aldehyde dehydrogenase 2 knockout accentuates ethanol-induced cardiac depression: Role of protein phosphatases.
J. Mol. Cell. Cardiol., 49: 322-9, 2010.
Okumura F., Matsunaga Y., Katayama Y., Nakayama KI., Hatakeyama S.
TRIM8 modulates STAT3 activity through negative regulation of PIAS3.
J. Cell Sci., 123: 2238-45, 2010.
Mizokami A., Tanaka H., IshibashiH., Umebayashi H., Fukami K., Takenawa T., Nakayama KI., Yokoyama T., Nabekura J., Kanematsu T., Hirata M.
GABA(A) receptor subunit alteration-dependent diazepam insensitivity in the cerebellum of phospholipase C-related inactive protein knockout mice.
J. Neurochem., 114: 302-10, 2010.
Benirschke RC., Thompson JR., Nominè Y., Wasielewski E., Juranić N., Macura S, Hatakeyama S., Nakayama KI., Botuyan MV., Mer G.
Molecular basis for the association of human E4B U-box ubiquitin ligase with E2 conjugating enzymes UbcH5c and Ubc.
Structure, 18: 955-65, 2010.
Hatano A., Matsumoto M., Higashinakagawa T., Nakayama KI.
Phosphorylation of the chromodomain changes the binding specificity of Cbx2 for methylated histone H3.
Biochem. Biophys. Res. Commun., 397: 93-99, 2010.
Gao Y., Gu C., Li S., Tokuyama T., Yokota N., Nakayama KI., Kitagawa M., Namba H.
p27 modulates tropism of mesenchymal stem cells toward brain tumors.
Exp. Ther. Med., in press.
Susaki E., Nakayama KI.
An animal model manifesting neurodegeneration and obesity.
Aging, 2: 453-6, 2010.
Tsukada Y., Nakayama KI.
In vitro histone demethylase assay.
Cold Spring Harb. Protoc., [Epub ahead of print].
Takeda H., Kawamura Y., Miura A., Mori M., Wakamatsu A., Yamamoto JI., Isogai T., Matsumoto M., Nakayama KI., Natsume T., Nomura N., Goshima N.
Comparative analysis of human src-family kinase substrate specificity in vitro.
J. Proteome Res., 9: 5982-93, 2010.
Hayakawa H., Fujikane A., Ito R., Matsumoto M., Nakayama KI., Sekiguchi M.
Human proteins that specifically bind to 8-oxoguanine-containing RNA and their responses to oxidative stress.
Biochem. Biophys. Res. Commun., 403: 220-4, 2010.
Ohzono C., Etoh S., Matsumoto M., Nakayama KI., Hirota Y., Tanaka Y., Fujita H.
Nedd4-interacting protein 2, a short half-life membrane protein degraded in lysosomes, negatively controls down-regulation of connexin43.
Biol. Pharm. Bull., 33: 951-7, 2010.
2009
Lu Y., Adegoke OAJ., Nepveu A., Nakayama KI., Bedard N., Cheng D., Peng J., Wing SS.
USP19 deubiquitinating enzyme supports cell proliferation 1 by stabilizing KPC1, a ubiquitin ligase for p27Kip1.
Mol. Cell. Biol., 29: 547-58, 2009.
Minhajuddin M., Bijli KM., Fazal F., Sassano A., Nakayama KI., Hay N., Platanias LC., Rahman A.
Protein kinase Cδ and PI 3-kinase/AKT activate mammalian target of rapamycin to modulate NF-κB activation and ICAM-1 expression in endothelial cells.
J. Biol. Chem., 284: 4052-61, 2009.
Endo A., Matsumoto M., Inada T., Yamamoto A., Nakayama KI., Kitamura N., Komada M.
Nucleolar structure and function regulated by a deubiquitinating enzyme USP36.
J. Cell Sci., 122: 678-86, 2009.
Nishiyama M., Oshikawa K., Tsukada Y., Nakagawa T., Iemura S., Natsume T., Fan Y., Kikuchi A., Skoultchi AI., Nakayama KI.
CHD8 suppresses p53-mediated apoptosis through histone H1 recruitment during early embryogenesis.
Nature Cell Biol., 11: 172-82, 2009.
Mitra P., Ghule PN., van Der Deen M., Medina R., Xie RL., Holmes WF., Ye X., Nakayama KI., Harper JW., Stein JL., Stein GS., van Wijnen AJ.
CDK inhibitors selectively diminish cell cycle controlled activation of the histone H4 gene promoter by p220NPAT and HiNF-P.
J. Cell. Physiol., 219: 438-48, 2009.
Tsukuba T., Yanagawa M., Okamoto K., Okamoto Y., Yasuda Y., Nakayama KI., Kadowaki T., Yamamoto K.
Impaired chemotaxis and cell adhesion due to decrease in wide range of cell-surface receptors in cathepsin E-deficient macrophages.
J. Biochem., 145: 565-73, 2009.
Susaki E., Nakayama K., Yamasaki L., Nakayama KI.
Common and specific roles of the related CDK inhibitors p27 and p57 revealed by a knock-in mouse model.
Proc. Natl. Acad. Sci. U.S.A., 106: 5192-7, 2009.
Lin HK., Wang G., Chen Z., Teruya-Feldstein J., Liu Y., Chan CH., Yang WL., Erdjument-Bromage H., Nakayama KI., Nimer S., Tempst P., Pandolfi PP.
Phosphorylation-dependent regulation of cytosolic localization and oncogenic function of Skp2 by Akt/PKB.
Nature Cell Biol., 11: 420-32, 2009.
Saita S., Shirane M., Natume T., Iemura S., Nakayama KI.
Promotion of neurite extension by protrudin requires its interaction with VAMP-associated protein (VAP).
J. Biol. Chem., 284: 13766-77, 2009.
Matsumoto M., Oyamada K., Takahashi H., Sato T., Hatakeyama S., Nakayama KI.
Large-scale proteomic analysis of tyrosine phosphorylation induced by TCR or BCR activation reveals new signaling pathways.
Proteomics, 9: 3549-63, 2009.
Kimura T., Sakai M., Tabu K., Wang L., Tsunematsu R., Tsuda M., Sawa H., Nagashima K., Nishihara H., Hatakeyama S., Nakayama K., Ladanyi M., Tanaka S., Nakayama KI.
Human synovial sarcoma proto-oncogene Syt is essential for early embryonic development through the regulation of cell migration.
Lab. Invest., 89: 645-56, 2009.
Yokobori T., Mimori K., Iwatsuki M., Ishii H., Onoyama I., Fukagawa T., Kuwano H., Nakayama KI., Mori M.
p53-altered FBXW7 expression determines poor prognosis in gastric cancer cases.
Cancer Res., 69: 3788-94, 2009.
Saiga T., Fukuda T., Matsumoto M., Tada H., Okano HO., Okano H., Nakayama KI.
Fbxo45 forms a novel ubiquitin ligase complex and is required for neuronal development.
Mol. Cell. Biol., 29: 3529-43, 2009.
Matsuda M., Tsutsumi K., Kanematsu T., Fukami K., Terada Y., Takenawa T., Nakayama KI., Hirata M.
Involvement of phospholipase C-related inactive protein in the mouse reproductive system through the regulation of gonadotropin levels.
Biol. Reprod., 81: 681-9, 2009.
Zhang J., Hung AC., Ng PY., Nakayama KI., Hu Y., Li B., Porter AG., Dhakshinamoorthy S.
PKCdelta mediates Nrf2-dependent protection of neuronal cells from NO-induced apoptosis.
Biochem. Biophys. Res. Commun., 386: 750-6, 2009.
Jiang X., Austin PF., Niederhoff RA., Manson SR., Riehm JJ., Cook BL., Pengue G., Chitaley K., Nakayama K., Nakayama KI., Weintraub SJ.
Mechanoregulation of proliferation.
Mol. Cell. Biol., 29: 5104-14, 2009.
Susaki E., Nakayama KI.
Functional similarities and uniqueness of p27 and p57: insight from a knock-in mouse model.
Cell. Cycle., 8: 2497-501, 2009.
Ranchal I., González R., Bello RI., Ferrín G., Hidalgo AB., Linares CI., Aguilar-Melero P., González-Rubio S., Barrera P., Marchal T., Nakayama KI., de la Mata M., Muntané J.
The reduction of cell death and proliferation by p27(Kip1) minimizes DNA damage in an experimental model of genotoxicity.
Int. J. Cancer, 125: 2270-80, 2009.
Oyamada A., Ikebe H., Itsumi M., Saiwai H., Okada S., Shimoda K., Iwakura Y., Nakayama KI., Iwamoto Y., Yoshikai Y., Yamada H.
Tyrosine kinase 2 plays critical roles in the pathogenic CD4 T cell responses for the development of experimental autoimmune encephalomyelitis.
J. Immunol., 183: 7539-46, 2009.
Wu YJ., Sala-Newby GB., Shu KT, Yeh HI., Nakayama KI., Nakayama K., Newby AC., Bond M.
S-phase kinase-associated protein-2 (Skp2) promotes vascular smooth muscle cell proliferation and neointima formation in vivo.
J. Vasc. Surg., 50: 1135-42, 2009.
2008
Gallegos JR., Litersky J., Lee H., Sun Y., Nakayama KI., Nakayama K., Lu H.
SCF TrCP1 activates and ubiquitylates TAp63gamma.
J. Biol. Chem., 283: 66-75, 2008.
Shigematsu N., Fukuda T., Yamamoto T., Nishioku T., Yamaguchi T., Himeno M., Nakayama KI., Tsukuba T., Kadowaki T., Okamoto K., Higuchi S., Yamamoto K.
Association of cathepsin E deficiency with the increased territorial aggressive response of mice.
J. Neurochem., 105: 1394-404, 2008.
Mukai A., Mizuno E., Kobayashi K., Matsumoto M., Nakayama KI., Kitamura N., Komada M.
Dynamic regulation of ubiquitination and deubiquitination at the central spindle during cytokinesis.
J. Cell Sci., 15: 121(Pt8), 2008.
Inoue S., Kinoshita T., Matsumoto M., Nakayama KI., Doi M., Shimazaki K.
Blue light-induced autophosphorylation of phototropin is a primary step for signaling.
Proc. Natl. Acad. Sci. U.S.A., 105: 5626-31, 2008.
Matsuoka S., Oike Y., Onoyama I., Iwama A., Arai F., Takubo K., Mashimo Y., Oguro H., Nitta E., Ito K., Miyamoto K., Yoshiwara H., Hosokawa K., Nakamura Y., Gomei Y., Iwasaki H., Hayashi Y., Matsuzaki Y, Nakayama K., Ikeda Y., Hata A., Chiba S., Nakayama KI., Suda T.
Fbxw7 acts as a critical failsafe against premature loss of hematopoietic stem cells and development of T-ALL.
Genes Dev., 22: 986-91, 2008.
Shirane M., Ogawa M., Motoyama J., Nakayama KI.
Regulation of apoptosis and neurite extension by FKBP38 is required for neural tube formation in the mouse.
Genes Cells, 13: 635-51, 2008.
Matsumoto A., Kawamoto T., Mutoh F., Isse T., Oyama T., Kitagawa K., Nakayama KI., Ichiba M.
Effects of 5-week ethanol feeding on the liver of aldehyde dehydrogenase 2 knockout mice.
Pharmacogenet. Genomics, 18: 847-52, 2008.
Tamamori-Adachi M., Takagi H., Hashimoto K., Goto K., Hidaka T., Koshimizu U., Yamada K., Goto I., Maejima Y., Isobe M., Nakayama KI., Inomata N., Shigetaka Kitajima S.
Cardiomyocyte proliferation and protection against post-myocardial infarction heart failure by cyclin D1 and Skp2 ubiquitin ligase.
Cardiovasc. Res., 80: 181-90, 2008.
Sakae N., Yamasaki N., Kitaichi K., Fukuda T., Yamada M., Yoshikawa H., Hiranita T., Tatsumi Y., Kira J., Yamamoto T., Miyakawa T., Nakayama KI.
Mice lacking the schizophrenia-associated protein FEZ1 manifest hyperactivity and enhanced responsiveness to psychostimulants.
Hum. Mol. Genet., 17: 3191-203, 2008.
Kanei-Ishii C., Nomura T., Takagi T., Watanabe N., Nakayama KI., Ishii S.
Fbxw7 acts as an E3 ubiquitin ligase that targets c-Myb for Nemo-like kinase (NLK)-induced degradation.
J. Biol. Chem., 283: 30540-8, 2008.
Onoyama I., Nakayama KI.
Fbxw7 in cell cycle exit and stem cell maintenance: insight from gene-targeted mice.
Cell Cycle, 7: 3307-13, 2008.
Miranda-Carboni GA., Krum SA., Yee K., Nava M., Deng QE., Pervin S., Collado-Hidalgo A., Galic Z., Zack JA., Nakayama K., Nakayama KI., Lane TF.
A functional link between Wnt signaling and SKP2-independent p27 turnover in mammary tumors.
Genes Dev., 22: 3121-34, 2008.
Ohsaki K., Oishi K., Kozono Y., Nakayama K., Nakayama KI., Ishida N.
The role of {beta}-TrCP1 and {beta}-TrCP2 in circadian rhythm generation by mediating degradation of clock protein PER2.
J. Biochem., 144: 609-18, 2008.
Ishikawa Y., Onoyama I., Nakayama KI., Nakayama K.
Notch-dependent cell cycle arrest and apoptosis in mouse embryonic fibroblasts lacking Fbxw7.
Oncogene, 27: 6164-74, 2008.
Agarwal A., Bumm TG., Corbin AS., O’Hare T., Loriaux M., VanDyke J., Willis SG., Deininger J., Nakayama KI., Druker BJ., Deininger MW.
Absence of SKP2 expression attenuates BCR-ABL-induced myeloproliferative disease.
Blood, 112: 1960-70, 2008.
Chen Q., Xie W., Kuhn DJ., Voorhees PM., Lopez-Girona A., Mendy D., Corral LG., Krenitsky VP., Xu W., Moutouh-de Parseval L., Webb DR., Mercurio F., Nakayama KI., Nakayama K., Orlowski RZ.
Targeting the p27 E3 ligase SCFSkp2 results in p27- and Skp2-mediated cell-cycle arrest and activation of autophagy.
Blood, 111: 4690-9, 2008.
Song MS., Song SJ., Kim SJ., Nakayama K., Nakayama KI., Lim DS.
Skp2 regulates the antiproliferative function of the tumor suppressor RASSF1A via ubiquitin-mediated degradation at the G1-S transition.
Oncogene, 27: 3176-85, 2008.
2007
Itoh Y., Masuyama N., Nakayama K., Nakayama KI., Gotoh Y.
The cdk inhibitors p57 and p27 regulate neuronal migration in the developing mouse neocortex.
J. Biol. Chem., 282: 390-6, 2007.
Yanagawa M, Tsukuba T, Nishioku T, Okamoto Y, Okamoto K, Takii R, Terada Y, Nakayama KI, Kadowaki T, Yamamoto K.
Cathepsin E deficiency induces a novel form of lysosomal storage disorder showing the accumulation of lysosomal membrane sialoglycoproteins and the elevation of lysosomal pH in macrophages.
J. Biol. Chem., 282: 1851-62, 2007.
Sakai T., Sakaue H., Nakamura T., Okada M., Matsuki Y., Watanabe E., Hiramatsu R., Nakayama K., Nakayama KI., Kasuga M.
Skp2 controls adipocyte proliferation during the development of obesity.
J. Biol. Chem., 282: 2038-46, 2007.
Shukla A., Lounsbury KM., Barrett TF, Gell J., Rincon M., Butnor KJ., Taatjes DJ., Davis GS., Vacek P., Nakayama KI., Nakayama K., Steele C., Mossman BT.
Asbestos-induced peribronchiolar cell proliferation and cytokine production are attenuated in lungs of protein kinase C-knockout mice.
Am. J. Pathol., 170: 140-51, 2007.
Uchida T., Iwashita N., Ohara-Imaizumi M., Ogihara T., Nagai S., Choi JB., Tamura Y., Tada N., Kawamori R., Nakayama KI., Nagamatsu S., Watada H.
PKC-delta plays non-redundant role in insulin secretion in pancreatic beta cell.
J. Biol. Chem., 282: 2707-2716, 2007.
Tu X., Joeng KS., Nakayama KI., Nakayama K., Rajagopal J., Carroll TJ., McMahon AP., Long F.
Noncanonical Wnt signaling through G protein-linked PKCdelta activation promotes bone formation.
Dev. Cell, 12: 113-27, 2007.
Moller C., Karlberg M., Abrink M., Nakayama KI., Motoyama N., Nilsson G.
Bcl-2 and Bcl-XL are indispensable for the late phase of mast cell development from mouse embryonic stem cells.
Exp. Hematol., 35: 385-93, 2007.
Nakagawa T., Shirane M., Iemura S., Natsume T., Nakayama KI.
Anchoring of the 26S proteasome to the organellar membrane by FKBP38.
Genes Cells, 12: 709-719, 2007.
Miyamoto K., Araki KY., Naka K., Arai F., Takubo K., Yamazaki S., Matsuoka S., Miyamoto T., Ito K., Ohmura M., Chen C., Hosokawa K., Nakauchi H., Nakayama K., Nakayama KI., Harada M., Motoyama N., Suda T., Hirao A.
Foxo3a is essential for maintenance of the hematopoietic stem cell pool.
Cell Stem Cell, 1: 101-12, 2007.
Matsuda T., Matsumoto A., Uchida M., Kanaly R., Misaki K., Shibutani S., Kawamoto T., Kitagawa K., Nakayama KI., Tomokuni K., Ichiba M.
Increased formation of hepatic N2-ethylidene-2′-deoxyguanosine DNA adducts in aldehyde dehydrogenase 2 knockout mice treated with ethanol.
Carcinogenesis, 28: 2363-6, 2007.
Liu Z., Liu X., Nakayama KI., Nakayama K., Ye K.
Protein kinase C-delta phosphorylates Ebp1 and prevents its proteolytic degradation, enhancing cell survival.
J. Neurochem., 100: 1278-88, 2007.
Mizokami A., Kanematsu T., Ishibashi H., Yamaguchi T., Tanida I., Takenaka K., Nakayama KI., Fukami K., Takenawa T., Kominami E., Moss SJ., Yamamoto T., Nabekura J., Hirata M.
Phospholipase C-related inactive protein is involved in trafficking of gamma2 subunit-containing GABA(A) receptors to the cell surface.
J. Neurosci., 27: 1692-701, 2007.
Susaki E., Nakayama K., Nakayama KI.
Cyclin D2 translocates p27 out of the nucleus and promotes its degradation at the G0-G1 transition.
Mol. Cell. Biol., 27: 4626-40, 2007.
Suzuki S., Fukasawa H., Kitagawa K., Uchida C., Hattori T., Isobe T., Oda T., Misaki T., Ohashi N., Nakayama K., Nakayama KI., Hishida A., Yamamoto T. Kitagawa M.
Renal damage in obstructive nephropathy is decreased in Skp2-deficient mice.
Am. J. Pathol., 171: 473-83, 2007.
Cooke PS., Holsberger DR., Cimafranca MA., Meling DD., Beals CM., Nakayama K., Nakayama KI., Kiyokawa H.
The F box protein Skp2 regulates adipose mass and adipocyte number in vivo.
Obesity, 15: 1400-8, 2007.
Wakeyama H., Akiyama T., Takahashi K., Amano H., Kadono Y., Nakamura M., Oshima Y., Itabe H., Nakayama KI., Nakayama K., Nakamura K., Tanaka S.
Negative feedback loop in Bim-caspase-3 axis regulating apoptosis and activity of osteoclasts.
J. Bone Miner. Res., 22: 1631-9, 2007.
Zhong L., Georgia S., Tschen S., Nakayama K., Nakayama KI., Bhushan A.
Skp2-mediated p27 degradation plays an essential role in the growth and adaptive expansion of pancreatic beta cells.
J. Clin. Invest., 117: 2869-76, 2007.
Ehre C., Zhu Y., Abdullah LH., Olsen JC., Nakayama KI., Nakayama K., Messing RO., Davis CW.
nPKC{epsilon}, a P2Y2-R downstream effector in regulated mucin secretion from airway goblet cells.
Am. J. Physiol., Cell Physiol., 293: 1445-54, 2007.
Li W., Yamada H., Yajima T., Nakagawa R., Shimoda K., Nakayama KI., Yoshikai Y.
Tyk2 signaling in host environment plays an important role in contraction of antigen-specific CD8 T cells following a microbial infection.
J. Immunol., 178: 4482-8, 2007.
Onoyama I., Tsunematsu R., Matsumoto A., Kimura T., de Alboran IM., Nakayama K., Nakayama KI.
Conditional inactivation of Fbxw7 impairs cell cycle exit during T cell differentiation and results in lymphomatogenesis.
J. Exp. Med., 204: 2875-88, 2007.
Susaki E., Nakayama KI.
Multiple mechanisms for p27Kip1 translocation and degradation.
Cell Cycle, 6: 3015-20, 2007.
Kawakubo T., Okamoto K., Iwata J., Shin M., Okamoto Y., Yasukochi A., Nakayama KI., Kadowaki T., Tsukuba T., Yamamoto K.
Cathepsin E prevents tumor growth and metastasis by catalyzing the proteolytic release of soluble TRAIL from tumor cell surface.
Cancer Res., 67: 10869-78, 2007.
2006
Shirane M., Nakayama KI.
Protrudin induces neurite formation by directional membrane trafficking.
Science, 314: 818-21, 2006.
Kase S., Yoshida K., Harada T., Harada C., Namekata K., Suzuki Y., Ohgami K., Shiratori K., Nakayama KI., Ohno S.
Phosphorylation of extracellular signal-regulated kinase and p27(KIP1) after retinal detachment.
Graefes Arch. Clin. Exp. Ophthalmol., 244: 352-8, 2006.
Kase S., Yoshida K., Ohgami K., Shiratori K., Suzuki Y., Nakayama KI., Ohno S.
Expression of cdc2 and p27(KIP1) phosphorylation in mitotic cells of the human retinoblastoma.
Int. J. Mol. Med., 17: 465-8, 2006.
Kase S., Yoshida K., Ohgami K., Shiratori K., Nakayama KI., Ohno S.
Phosphorylation of p27(KIP1) in the mitotic cells of the corneal epithelium.
Curr. Eye Res., 31: 307-12, 2006.
Nishitani H., Sugimoto N., Roukos V., Nakanishi Y., Saijo M., Obuse C., Tsurimoto T., Nakayama KI., Nakayama K., Fujita M., Lygerou Z., Nishimoto T.
Two E3 ubiquitin ligases, SCF-Skp2 and DDB1-Cul4, target human Cdt1 for proteolysis.
EMBO J., 25: 1126-36, 2006.
Humphries MJ., Limesand KH., Schneider JC., Nakayama KI., Anderson SM., Reyland ME.
Suppression of apoptosis in the PKCδ null mouse in vivo.
J. Biol. Chem., 281: 9728-37, 2006.
Yoshida K., Yamaguchi T., Shinagawa H., Taira N., Nakayama KI., Miki Y.
Protein kinase Cδ activates topoisomerase IIα to induce apoptotic cell death in response to DNA damage.
Mol. Cell. Biol., 26: 3414-31, 2006.
Parcellier A., Brunet M., Schmitt E., Col E., Didelot C., Hammann A., Nakayama K., Nakayama KI., Khochbin S., Solary E., Garrido C.
HSP27 favors ubiquitination and proteasomal degradation of p27Kip1 and helps S-phase re-entry in stressed cells.
FASEB J., 20: 1179-81, 2006.
Sugihara E., Kanai M., Saito S., Nitta T., Toyoshima H., Nakayama K., Nakayama KI., Fukasawa K. Schwab M., Saya H., Miwa M.
Suppression of centrosome amplification after DNA damage depends on p27 accumulation.
Cancer Res., 66: 4020-9, 2006.
Niki S., Oshikawa K., Mouri Y., Hirota F., Matsushima A., Yano M., Han H., Bando Y., Izumi K., Matsumoto M., Nakayama KI., Kuroda N., Matsumoto M.
Alteration of intra-pancreatic target-organ specificity by abrogation of Aire in NOD mice.
J. Clin. Invest., 116: 1292-1301, 2006.
Ryer EJ., Hom RP., Sakakibara K., Nakayama KI., Nakayama K., Faries PL., Liu B., Kent KC.
PKCdelta is necessary for Smad3 expression and transforming growth factorbeta-induced fibronectin synthesis in vascular smooth muscle cells.
Arterioscler. Thromb. Vasc. Biol., 26: 780-6, 2006.
Iwanaga R., Komori H., Ishida S., Okamura N., Nakayama K., Nakayama KI. Ohtani K.
Identification of novel E2F1 target genes regulated in cell cycle-dependent and independent manners.
Oncogene, 25: 1786-98, 2006.
Nakayama KI., Nakayama K.
Ubiquitin ligases: cell-cycle control and cancer.
Nature Rev. Cancer, 6: 369-81, 2006.
Fotovati A., Nakayama K., Nakayama KI.
Impaired germ cell development due to compromised cell cycle progression in Skp2-deficient mice.
Cell Div., 1: 4, 2006.
Fujii Y., Yada M., Nishiyama M., Kamura T., Takahashi H., Tsunematsu R., Susaki E., Nakagawa T., Matsumoto A., Nakayama KI.
Fbxw7 contributes to tumor suppression by targeting multiple proteins for ubiquitin-dependent degradation.
Cancer Sci., 97: 729-36, 2006.
Shimazu T., Komatsu Y., Nakayama KI., Fukazawa H., Horinouchi S., Yoshida M.
Regulation of SV40 large T antigen stability by reversible acetylation.
Oncogene, 25: 7391-400, 2006.
Kanematsu T., Yasunaga A., Mizoguchi Y., Kuratani A., Kittler JT., Jovanovic JN., Takenaka K., Nakayama KI., Fukami K., Takenawa T., Moss SJ., Nabekura J., Hirata M.
Modulation of GABA(a) receptor phosphorylation and membrane trafficking by phospholipase C-related inactive protein/protein phosphatase 1 and 2A signaling complex underlying BDNF-dependent regulation of GABAergic inhibition.
J. Biol. Chem., 281: 22180-9, 2006.
Tsunematsu R., Nishiyama M., Kotoshiba S., Saiga T., Kamura T., Nakayama KI.
Fbxw8 is essential for Cul1-Cul7 complex formation and for placental development.
Mol. Cell. Biol., 26: 6157-69, 2006.
Nojima T., Hayashi K., Goitsuka R., Nakayama K., Nakayama KI., Kitamura D.
Double knockout mice show BASH and PKCd have different epistatic relationships in B cell maturation and CD40-mediated activation.
Immunol. Lett., 105: 48-54, 2006.
Hiramatsu Y., Kitagawa K., Suzuki T., Uchida C., Hattori T., Kikuchi H., Oda T., Hatakeyama S., Nakayama KI., Yamamoto T., Konno H., Kitagawa M.
Degradation of Tob1 mediated by SCFSkp2-dependent ubiquitination.
Cancer Res., 66: 8477-83, 2006.
Hara K., Nakayama KI., Nakayama K.
Geminin is essential for the development of preimplantation mouse embryos.
Genes Cells, 11: 1281-93, 2006.
Pula G., Schuh K., Nakayama K., Nakayama KI., Walter U., Poole AW.
PKCδ regulates collagen-induced platelet aggregation through inhibition of VASP-mediated filopodia formation.
Blood, 108: 4035-44, 2006.
Takahashi A., Ohtani N., Yamakoshi K., Iida S., Tahara H., Nakayama K., Nakayama KI., Ide T., Saya H., Hara E.
Mitogenic signalling and the p16INK4a/Rb pathway co-operate to enforce irreversible cellular senescence through activating ROS/PKC-δ signalling pathway.
Nature Cell Biol., 8: 1291-7, 2006.
Matsumoto A., Onoyama I., Nakayama KI.
Expression of mouse Fbxw7 isoforms is regulated in a cell cycle- or p53-dependent manner.
Biochem. Biophys. Res. Commun., 350: 114-9, 2006.
Shukla A., Barrett TF., Nakayama KI., Nakayama K., Mossman BT., Lounsbury KM.
Transcriptional up-regulation of MMPs 12 and 13 by asbestos occurs via a PKC -dependent pathway in murine lung.
FASEB J., 20: 997-9, 2006.
Tsukuba T., Yamamoto S., Yanagawa M., Okamoto K., Okamoto Y., Nakayama KI., Kadowaki T., Yamamoto K.
Cathepsin E-deficient mice show increased susceptibility to bacterial infection associated with the decreased expression of multiple cell surface Toll-like receptors.
J. Biochem., 140: 57-66, 2006.
Gao Y., Kitagawa K., Hiramatsu Y., Kikuchi H., Isobe T., Shimada M., Uchida C., Hattori T., Oda T., Nakayama K., Nakayama KI. Tanaka T., Konno H. Kitagawa M.
Up-regulation of GPR48 induced by down-regulation of p27Kip1 enhances carcinoma cell invasiveness and metastasis.
Cancer Res., 66: 11623-31, 2006.
2005
Jackson D., Zheng Y., Lyo D., Shen Y., Nakayama K., Nakayama KI., Humphries MJ., Reyland ME., Foster DA.
Suppression of cell migration by protein kinase Cδ.
Oncogene, 24: 3067-72, 2005.
Harada K., Takeuchi H., Oike M., Matsuda M., Kanematsu T., Yagisawa H., Nakayama KI., Maeda K., Christophe E., Hirata M.
Role of PRIP-1, a novel Ins(1,4,5)P3 binding protein, in Ins(1,4,5)P3-mediated Ca2+ signaling.
J. Cell. Physiol., 202: 422-33, 2005.
Kotake Y., Nakayama K., Ishida N., Nakayama KI.
Role of serine-10 phosphorylation in p27 stabilization revealed by analysis of p27 knock-in mice harboring a serine-10 mutation.
J. Biol. Chem., 280: 1095-102, 2005.
Takahashi H., Hatakeyama S., Saitoh H., Nakayama KI.
Noncovalent SUMO-1 binding activity of thymine DNA glycosylase (TDG) is required for its SUMO-1 modification and colocalization with the promyelocytic leukemia protein (PML).
J. Biol. Chem., 280: 5611-21, 2005.
Rodier G., Makris C., Coulombe P., Nakayama K., Nakayama KI., Meloche S.
p107 inhibits G1 phase progression by down-regulating expression of the F-box protein Skp2.
J. Cell Biol., 168: 55-66, 2005.
He CH., Waxman AB., Lee CG., Link H., Rabach ME., Ma B., Chen Q., Zhu Z., Zhong M., Nakayama K., Nakayama KI., Homer RJ., Elias JA.
Bcl-2-related protein A1 is an endogenous and cytokine-stimulated mediator of cytoprotection in hyperoxic acute lung injury.
J. Clin. Invest., 115: 1039-48, 2005.
Matsumoto M., Hatakeyama S., Oyamada K., Oda Y., Nishimura T., Nakayama KI.
Large-scale analysis of the human ubiquitin-related proteome.
Proteomics, 5: 4145-51., 2005.
Uchida T., Nakamura T., Hashimoto N., Matsuda T., Kotani K., Sakaue H., Kido Y., Hayashi Y., Nakayama KI, White MF., Kasuga M.
Deletion of Cdkn1b ameliorates hyperglycemia by maintaining compensatory hyperinsulinemia in diabetic mice.
Nature Med., 11: 175-82, 2005.
Kase S., Nakayama KI., Nakayama K., Ikeda H., Harada T., Harada C., Ohgami K., Shiratori K., Ohno S., Yoshida K.
Phosphorylation of p27(KIP1) in the developing retina and retinoblastoma.
Int. J. Mol. Med., 16: 257-62, 2005.
Kotoshiba S., Kamura T., Hara T., Ishida N., Nakayama KI.
Molecular dissection of the interaction between p27 and Kip1 ubiquitylation-promoting complex, the ubiquitin ligase that regulates proteolysis of p27 in G1 Phase.
J. Biol. Chem., 280: 17694-700, 2005.
Kase S., Ikeda H., Harada T., Harada C., Imaki J., Ohgami K., Shiratori K., Nakayama KI., Nakayama K., Ohno S., Yoshida K.
Disappearance of p27(KIP1) and increase in proliferation of the lens cells after extraction of most of the fiber cells of the lens.
Curr. Eye Res., 30: 437-42, 2005.
Wang HQ., Nakaya Y., Du Z., Yamane T., Shirane M., Kudo T., Takeda M., Takebayashi K., Noda Y., Nakayama KI., Nishimura M.
Interaction of presenilins with FKBP38 promotes apoptosis by reducing mitochondrial Bcl-2.
Hum. Mol. Genet., 14: 1889-902, 2005.
Jiang H., Chang FC., Ross AE., Lee J., Nakayama KI., Nakayama K, Desiderio S.
Ubiquitylation of RAG-2 by Skp2-SCF links destruction of the V(D)J recombinase to the cell cycle.
Mol. Cell, 18: 699-709, 2005.
Hatakayama S., Watanabe M., Fujii Y., Nakayama KI.
Targeted destruction of c-Myc by an engineered ubiquitin ligase suppresses cell transformation and tumor formation.
Cancer Res., 65: 7874-9, 2005.
Pushkarsky T., Yurchenko V., Vanpouille C., Brichacek B., Vaisman I., Hatakeyama S., Nakayama KI., Sherry B., Bukrinsky MI.
Cell surface expression of CD147/emmprin is regulated by cyclophilin 60.
J. Biol. Chem., 280: 27866-71, 2005.
Hino S., Tanji C., Nakayama KI., Kikuchi A.
Phosphorylation of beta-catenin by cyclic AMP-dependent protein kinase stabilizes beta-catenin through inhibition of its ubiquitination.
Mol. Cell. Biol., 25: 9063-72, 2005.
Hara T., Kamura T., Kotoshiba S., Takahashi H., Fujiwara K., Onoyama I., Shirakawa M., Mizushima N., Nakayama KI.
Role of the UBL-UBA protein KPC2 in degradation of p27 at G1 phase of the cell cycle.
Mol. Cell. Biol., 25: 9292-303, 2005.
Chen Z., Foster MW., Zhang J., Mao L., Rockman HA., Kawamoto T., Kitagawa K., Nakayama KI., Hess DT., Stamler JS.
An essential role for mitochondrial aldehyde dehydrogenase in nitroglycerin bioactivation.
Proc. Natl. Acad. Sci. U.S.A., 102: 12159-64, 2005.
Kaneko-Oshikawa C., Nakagawa T., Yamada M., Yoshikawa H., Matsumoto M., Yada M., Hatakeyama S., Nakayama K., Nakayama KI.
Mammalian E4 is required for cardiac development and maintenance of the nervous system.
Mol. Cell. Biol., 25: 10953-64, 2005.
Yogosawa S., Hatakeyama S., Nakayama KI., Miyoshi H., Kohsaka S., Akazawa C.
Ubiquitylation and degradation of polo-like kinase SNK by hVPS18, a RING-H2 type ubiquitin ligase.
J. Biol. Chem., 280: 41619-27, 2005.
Nakayama KI., Nakayama K.
Regulation of the cell cycle by SCF-type ubiquitin ligases.
Semin. Cell. Dev. Biol., 16: 323-33, 2005.
2004
Nakayama K., Nagahama H., Minamishima YA., Miyake S., Ishida N., Hatakeyama S., Kitagawa M., Iemura S., Natsume T., Nakayama KI.
Skp2-mediated degradation of p27 regulates progression into mitosis.
Dev. Cell, 6: 661-72, 2004.
Kamura T., Hara T., Matsumoto M., Ishida N., Okumura F., Hatakeyama S., Yoshida M., Nakayama K., Nakayama KI.
Cytoplasmic ubiquitin ligase KPC regulates proteolysis of p27(Kip1) at G1 phase.
Nature Cell Biol., 6: 1229-35, 2004.
Yoshida K., Nakayama K., Kase S., Nagahama H., Harada T., Ikeda H., Harada C., Imaki J., Ohgami K., Shiratori K., Ohno S., Nishi S., Nakayama KI.
Involvement of p27(KIP1) in proliferation of the retinal pigment epithelium and ciliary body.
Anat. Embryol., 208: 145-50, 2004.
Uchida D., Hatakeyama S., Matsushima A., Han H., Ishido S., Hotta H., Kudoh J., Shimizu N., Doucas V., Nakayama KI., Kuroda N., Matsumoto M.
AIRE Functions As an E3 Ubiquitin Ligase.
J. Exp. Med., 199: 167-72, 2004.
Tsunematsu R., Nakayama K., Oike Y., Nishiyama M., Ishida N., Hatakeyama S., Bessho Y., Kageyama R., Suda T., Nakayama KI.
Mouse Fbw7/Sel-10/Cdc4 is required for notch degradation during vascular development.
J. Biol. Chem., 279: 9417-23, 2004.
Matsumoto M., Yada M., Hatakeyama S., Ishimoto H., Tanimura T., Tsuji S., Kakizuka A., Kitagawa M., Nakayama KI.
Molecular clearance of ataxin-3 is regulated by a mammalian E4.
EMBO J., 23: 659-69, 2004.
Yoshida K., Kase S., Nakayama K., Nagahama H., Harada T., Ikeda H., Harada C., Imaki J., Ohgami K., Shiratori K., Ilieva IB., Ohno S., Nishi S., Nakayama KI. Yoshida K., Kase S., Nakayama K., Nagahama H., Harada T., Ikeda H., Harada C., Imaki J., Ohgami K., Shiratori K., Ilieva IB., Ohno S., Nishi S., Nakayama KI.
Involvement of p27(KIP1) in the proliferation of the developing corneal endothelium.
Invest. Ophthalmol. Vis. Sci., 45: 2163-2167, 2004.
Yoshida K., Kase S., Nakayama K., Nagahama H., Harada T., Ikeda H., Harada C., Imaki J., Ohgami K., Shiratori K., Ohno S., Nakayama KI.
Distribution of p27(KIP1), cyclin D1 and proliferating cell nuclear antigen after retinal detachment.
Graefes Arch. Clin. Exp. Ophthalmol., 242: 437-41, 2004.
Ohtsuka T., Ryu H., Minamishima YA., Macip S., Sagara J., Nakayama KI., Aaronson SA., Lee SW.
ASC is a Bax adaptor and regulates the p53-Bax mitochondrial apoptosis pathway.
Nature Cell Biol., 6: 121-8, 2004.
Oh KJ., Kalinina A., Wang J., Nakayama K., Nakayama KI., Bagchi S.
The papillomavirus E7 oncoprotein is ubiquitinated by UbcH7 and Cullin1/Skp2 containing E3 ligase.
J. Virol., 78: 5338-46, 2004.
Urushitani M., Kurisu J., Tateno M., Hatakeyama S., Nakayama KI., Kato S., Takahashi R.
CHIP promotes proteasomal degradation of familial ALS-linked mutant SOD1 by ubiquitinating Hsp/Hsc70.
J. Neurochem., 90: 231-44, 2004.
Hatakeyama S., Matsumoto M., Yada M., Nakayama KI.
Interaction of U-box-type ubiquitin-protein ligases (E3s) with molecular chaperones.
Genes Cells, 9: 533-48, 2004.
Yada M., Hatakeyama S., Kamura T., Nishiyama M., Tsunematsu R., Imaki H., Ishida N., Okumura F., Nakayama K., Nakayama KI.
Phosphorylation-dependent degradation of c-Myc is mediated by the F-box protein Fbw7.
EMBO J., 23: 2116-25, 2004.
Li B., Wang X., Rasheed N., Hu Y., Boast S., Ishii T., Nakayama K., Nakayama KI., Goff SP.
Distinct roles of c-Abl and Atm in oxidative stress response are mediated by protein kinase Cδ.
Genes Dev., 18: 1824-37, 2004.
Komatsu T., Mizusaki H., Mukai T., Ogawa H., Baba D., Shirakawa M., Hatakeyama S, Nakayama KI., Yamamoto H., Kikuchi A., Morohashi K.
SUMO-1 modification of the synergy control motif of Ad4BP/SF-1 regulates synergistic transcription between Ad4BP/SF-1 and Sox9.
Mol. Endocrinol., 18: 2451-62, 2004.
Akiyoshi H., Hatakeyama S., Pitkanen J., Mouri Y., Doucas V., Kudoh J., Tsurugaya K., Uchida D., Matsushima A., Oshikawa K., Nakayama KI., Shimizu N., Peterson P., Matsumoto M.
Subcellular expression of autoimmune regulator (AIRE) is organized in a spatiotemporal manner.
J. Biol. Chem., 279: 33984-91, 2004.
Terunuma M., Kanematsu T., Sang HH., Il-Sung J., Jasmina NJ., Nakayama KI., Akaike N., Sung HR., Stephen JM., Hirata M.
GABAA receptor phospho-dependent modulation is regulated by PRIP-1, a novel protein phosphatase 1 anchoring protein.
J. Neurosci., 11: 7074-84, 2004.
Nishiyama M., Nakayama K., Tsunematsu R., Tsukiyama T., Kikuchi A., Nakayama KI.
Early embryonic death in mice lacking the beta-catenin-binding protein Duplin.
Mol. Cell. Biol., 24: 8386-94, 2004.
Kamezaki K., Shimoda K., Numata A., Matsuda T., Nakayama KI., Harada M.
The role of Tyk2, Stat1 and Stat4 in LPS-induced endotoxin signals.
Int. Immunol., 16: 1173-9, 2004.
Tokarz SA., Berset C., La Rue JM., Friedman K., Nakayama KI., Nakayama K., Zhang DE., Lanker S.
The ISG15 isopeptidase UBP43 is regulated by proteolysis via the SCF(Skp2) ubiquitin ligase.
J. Biol. Chem., 279: 46424-30, 2004.
Tamamori-Adachi M., Hayashida K., Nobori K., Omizu C., Yamada K., Sakamoto N., Kamura T., Fukuda K., Ogawa S., Nakayama KI., Kitajima S.
Down-regulation of p27Kip1 promotes cell proliferation of rat neonatal cardiomyocytes induced by nuclear expression of cyclin D1 and CDK4: Evidence for impaired Skp2-dependent degradation of p27 in terminal differentiation.
J. Biol. Chem., 279: 50429-36, 2004.
Yamaguchi T., Kubota T., Kanematsu T., Nakayama KI., Hirata M., Yamamoto T.
Hypersensitivity to pentylenetetrazol-induced convulsion in mice lacking the PLC-related inactive protein-1.
Brain Res., 1025: 237-40, 2004.
Okumura F., Hatakeyama S., Matsumoto M., Kamura T., Nakayama KI.
Functional regulation of FEZ1 by the U-box-type ubiquitin ligase E4B contributes to neuritogenesis.
J. Biol. Chem., 279: 53533-43, 2004.
Hatakeyama S., Matsumoto M., Kamura T., Murayama M., Chui DH., Planel E., Takahashi R. Nakayama KI., Takashima A.
U-box protein carboxyl terminus of Hsc70-interacting protein (CHIP) mediates poly-ubiquitylation preferentially on four-repeat Tau and is involved in neurodegeneration of tauopathy.
J. Neurochem., 91: 299-307, 2004.
Kamura T., Maenaka K., Kotoshiba S., Matsumoto M., Kohda D., Conaway RC., Conaway JW., Nakayama KI.
VHL-box and SOCS-box domains determine binding specificity for Cul2-Rbx1 and Cul5-Rbx2 modules of ubiquitin ligases.
Genes Dev., 18: 3055-65, 2004.
Blaschke F., Leppaenen O., Takata Y., Caglayan E., Liu J., Fishbein MC., Kappert K., Nakayama KI., Fleck E., Hsueh WA., Law RE., Bruemmer D.
Liver X receptor agonists suppress vascular smooth muscle cell proliferation and inhibit neointima formation in balloon-injured rat carotid arteries.
Circ. Res., 95: e110-23, 2004.
Mao JH., Perez-losada J., Wu D., DelRosario R., Tsunematsu R., Nakayama KI., Brown K., Bryson S., Balmain A.
Fbxw7/Cdc4 is a p53-dependent, haploinsufficient tumour suppressor gene.
Nature, 432: 775-9, 2004.
Mirza AM., Gysin S., Malek N, Nakayama KI., Roberts JM., McMahon M.
Cooperative regulation of the cell division cycle by the protein kinases RAF and AKT.
Mol. Cell. Biol., 24: 10868-81, 2004.
Mori Y., Hirose K., Suzuki K., Nakajima H., Seto Y, Ikeda K., Shimoda K., Nakayama KI., Saito Y., Iwamoto I.
Tyk2 is essential for IFN-alpha-induced gene expression in mast cells.
Int. Arch. Allergy Immunol., 134: 25-2, 2004.
2003
Shirane M, Nakayama KI.
Inherent calcineurin inhibitor FKBP38 targets Bcl-2 to mitochondria and inhibits apoptosis.
Nature Cell Biol., 5: 28-37, 2003.
Hatakeyama S., Nakayama KI.
U-box proteins as a new family of ubiquitin ligases.
Biochem. Biophys. Res. Commun., 302: 635-45, 2003.
Kamura T., Hara T., Kotoshiba S., Yada M., Ishida N., Imaki H., Hatakeyama S., Nakayama K., Nakayama KI.
Degradation of p57Kip2 mediated by SCFSkp2-dependent ubiquitylation.
Proc. Natl. Acad. Sci. U.S.A., 100: 10231-6, 2003.
Seto Y., Nakajima H., Suto A., Shimoda K., Saito Y., Nakayama K.I., Iwamoto I.
Enhanced Th2 cell-mediated allergic inflammation in Tyk2-deficient mice.
J. Immunol., 170: 1077-83, 2003.
Kaneko C., Hatakeyama S., Matsumoto M., Yada M., Nakayama K., Nakayama KI.
Characterization of the mouse gene for the U-box-type ubiquitin ligase UFD2a.
Biochem. Biophys. Res. Comm., 300: 297-304, 2003.
Kitamura K., Mizuno K., Etoh A., Akita Y., Miyamoto A., Nakayama K., Ohno S.
The second phase activation of protein kinase C delta at late G1 is required for DNA synthesis in serum-induced cell cycle progression.
Genes Cells, 8: 311-24, 2003.
Oshikawa K., Matsumoto M., Yada M., Kamura T., Hatakeyama S., Nakayama KI.
Preferential interaction of TIP120A with Cul1 that is not modified by NEDD8 and not associated with Skp1.
Biochem. Biophys. Res. Comm., 303: 1209-16, 2003.
Zhang YW., Nakayama K., Nakayama K., Morita I.
A novel route for connexin 43 to inhibit cell proliferation: negative regulation of S-phase kinase-associated protein (Skp 2).
Cancer Res., 63: 1623-30, 2003.
von der Lehr N., Johansson S., Wu S., Bahram F., Castell A., Cetinkaya C., Hydbring P., Weidung I., Nakayama K., Nakayama KI., Soderberg O., Kerppola TK., Larsson LG.
The F-box protein Skp2 participates in c-Myc proteosomal degradation and acts as a cofactor for c-Myc-regulated transcription.
Mol. Cell, 11: 1189-200, 2003.
Bornstein G., Bloom J., Sitry-Shevah D., Nakayama K., Pagano M., Hershko A.
Role of the SCFSkp2 ubiquitin ligase in the degradation of p21Cip1 in S phase.
J. Biol. Chem., 278: 25752-7, 2003.
Imaki H., Nakayama K., Delehouzee S., Handa H., Kitagawa M., Kamura T., Nakayama KI.
Cell cycle-dependent regulation of the Skp2 promoter by GA-binding protein.
Cancer Res., 63: 4607-13, 2003.
Nakayama K., Hatakeyama S., Maruyama S., Kikuchi A., Onoe K., Good RA., Nakayama KI.
Impaired degradation of inhibitory subunit of NF-kappa B (I kappa B) and beta-catenin as a result of targeted disruption of the beta-TrCP1 gene.
Proc. Natl. Acad. Sci. U.S.A., 100: 8752-7, 2003.
Foster JS., Fernando RI., Ishida N., Nakayama KI., Wimalasena J.
Estrogens down-regulate p27Kip1 in breast cancer cells through Skp2 and through nuclear export mediated by the ERK pathway.
J. Biol. Chem., 278: 41355-66, 2003.
Watahiki J., Yamaguchi T., Irie T., Takahashi K., Nakano H., Yagasaki Y., Nakayama KI., Nakayama K., Maki K. Tachikawa T.The role of p57Kip2 on mandibular growth in mice: By means of laser microdissection for hard tissues.
Orthod. Waves, 62: 201-6, 2003.
Kato K., Kamezaki K., Shimoda K., Numata A., Haro T., Aoki K., Ishikawa F., Takase K., Ariyama H., Matsuda T., Miyamoto T., Nagafuji K., Gondo H., Nakayama K., Harada M.
Intracellular signal transduction of interferon on the suppression of haematopoietic progenitor cell growth.
Br. J. Haematol., 123: 528-35, 2003.
Chang TS., Kim MJ., Ryoo K., Park J., Eom SJ., Shim J., Nakayama KI., Nakayama K., Tomita M., Takahashi K., Lee MJ., Choi EJ.
p57KIP2 modulates stress-activated signaling by inhibiting c-Jun NH2-terminal kinase/stress-activated protein Kinase.
J. Biol. Chem., 278: 48092-8, 2003.
Aoki K., Shimoda K., Oritani K., Matsuda T., Kamezaki K., Muromoto R., Numata A., Tamiya S., Haro T., Ishikawa F., Takase K., Yamamoto T., Yumioka T., Miyamoto T., Nagafuji K., Gondo H., Nagafuchi S., Nakayama K., Harada M.
Limitin, an interferon-like cytokine, transduces inhibitory signals on B-cell growth through activation of Tyk2, but not Stat1, followed by induction and nuclear translocation of Daxx.
Exp. Hematol., 31: 1317-22, 2003.
Tsukuba T., Okamoto K., Okamoto Y., Yanagawa M., Kohmura K., Yasuda Y., Uchi H., Nakahara T., Furue M., Nakayama K., Kadowaki T., Yamamoto K., Nakayama KI.
Association of cathepsin E deficiency with development of atopic dermatitis.
J. Biochem., 134: 893-902, 2003.
Hatakeyama S., Nakayama KI.
Ubiquitylation as a quality control system for intracellular proteins.
J. Biochem., 134: 1-8, 2003.
2002
Miyamoto A., Nakayama K., Imaki H., Hirose S., Jiang Y., Abe M., Tsukiyama T., Nagahama H., Ohno S., Hatakeyama S., Nakayama KI.
Increased proliferation of B cells and auto-immunity in mice lacking protein kinase Cdelta.
Nature, 416: 865-9, 2002.
Ishida N., Hara T., Kamura T., Yoshida M., Nakayama K., Nakayama KI.
Phosphorylation of p27Kip1 on serine 10 is required for its binding to CRM1 and nuclear export.
J. Biol. Chem., 277: 14355-8, 2002.
Yoshida K., Nakayama K., Nagahama H., Harada T., Harada C., Imaki J., Matsuda A., Yamamoto K., Ito M., Ohno S., Nakayama K.
Involvement of p27(KIP1) degradation by Skp2 in the regulation of proliferation in response to wounding of corneal epithelium.
Invest. Ophthalmol. Vis. Sci., 43: 364-70, 2002.
Yamanaka A., Yada M., Imaki H., Koga M., Ohshima Y., Nakayama KI.
Multiple Skp1-related proteins in Caenorhabditis elegans: diverse patterns of interaction with Cullins and F-box proteins.
Curr. Biol., 12: 267-75, 2002.
Ikebe C., Kominami K., Toda T., Nakayama K.
Isolation and characterization of a novel F-box protein Pof10 in fission yeast.
Biochem. Biophys. Res. Comm., 290: 1399-407, 2002.
Minamishima YA., Nakayama K., Nakayama K.
Recovery of liver mass without proliferation of hepatocytes after partial hepatectomy in Skp2-deficient mice.
Cancer Res., 62: 995-9, 2002.
Murillas R., Simms KS., Hatakeyama S., Weissman AM., Kuehn MR.
Identification of developmentally expressed proteins that functionally interact with Nedd4 ubiquitin ligase.
J. Biol. Chem., 277: 2897-907, 2002.
Koguchi K., Nakatsuji Y., Nakayama K., Sakoda S.
Modulation of astrocyte proliferation by cyclin-dependent kinase inhibitor p27(Kip1).
Glia., 37: 93-104, 2002.
Kanematsu T., Jang IS., Yamaguchi T., Nagahama H., Yoshimura K., Hidaka K., Matsuda M., Takeuchi H., Misumi Y., Nakayama K., Yamamoto T., Akaike N., Hirata M., Nakayama KI.
Role of the PLC-related, catalytically inactive protein p130 in GABA(A) receptor function.
EMBO J., 21: 1004-11, 2002.
Shimoda K., Tsutsui H., Aoki K., Kato K., Matsuda T., Numata A., Takase K., Yamamoto T., Nukina H., Hoshino T., Asano Y., Gondo H., Okamura T., Okamura S., Nakayama K., Nakanishi K., Niho Y., Harada M.
Partial impairment of interleukin-12 (IL-12) and IL-18 signaling in Tyk2-deficient mice.
Blood, 99: 2094-9, 2002.
Nakamichi I., Hatakeyama S., Nakayama KI.
Formation of Mallory body-like inclusions and cell death induced by deregulated expression of keratin 18.
Mol. Biol. Cell, 13: 3441-51, 2002.
Imai Y., Soda M., Hatakeyama S., Akagi T., Hashikawa T., Nakayama KI., Takahashi R.
CHIP is associated with Parkin, a gene responsible for familial Parkinson’s disease, and enhances its ubiquitin ligase activity.
Mol. Cell, 10: 55-67, 2002.
Shimoda K, Kamesaki K, Numata A, Aoki K, Matsuda T, Oritani K, Tamiya S, Kato K, Takase K, Imamura R, Yamamoto T, Miyamoto T, Nagafuji K, Gondo H, Nagafuchi S, Nakayama K, Harada M.
Cutting edge: tyk2 is required for the induction and nuclear translocation of Daxx which regulates IFN-alpha-induced suppression of B lymphocyte formation.
J Immunol., 169: 4707-11, 2002.
Masuda TA., Inoue H., Sonoda H., Mine S., Yoshikawa Y., Nakayama K., Nakayama K., Mori M.
Clinical and biological significance of S-phase kinase-associated protein 2 (Skp2) gene expression in gastric carcinoma: modulation of malignant phenotype by Skp2 overexpression, possibly via p27 proteolysis.
Cancer Res., 62: 3819-25, 2002.
Garcia-Fernandez LF., Losada A., Alcaide V., Alvarez AM., Cuadrado A., Gonzalez L., Nakayama K., Nakayama KI., Fernandez-Sousa JM., Munoz A., Sanchez-Puelles JM.
Aplidin induces the mitochondrial apoptotic pathway via oxidative stress-mediated JNK and p38 activation and protein kinase C delta.
Oncogene, 21: 7533-44, 2002.
Tomari S., Nagahama H., Shu Y., Hoshi S., Nakayama K., Nakayama KI., Nagata M.
Glomerular differentiation in p27 and p57 double-mutant metanephroi.
Anat. Embryol., 206: 31-6, 2002.
2001
Hatakeyama S., Yada M., Matsumoto M., Ishida N., Nakayama KI.
U box proteins as a new family of ubiquitin-protein ligases.
J. Biol. Chem., 276: 33111-20, 2001.
Hara T., Kamura T., Nakayama K., Oshikawa K., Hatakeyama S., Nakayama K.
Degradation of p27(Kip1) at the G(0)-G(1) transition mediated by a Skp2-independent ubiquitination pathway.
J. Biol. Chem., 276: 48937-43, 2001.
Nakayama KI., Hatakeyama S., Nakayama K.
Regulation of the cell cycle at the G1-S transition by proteolysis of cyclin E and p27Kip1.
Biochem. Biophys. Res. Comm. [Review],, 282: 853-60, 2001.
Tsukiyama T., Ishida N., Shirane M., Minamishima YA., Hatakeyama S., Kitagawa M., Nakayama K., Nakayama K.
Down-regulation of p27Kip1 expression is required for development and function of T cells.
J. Immunol., 166: 304-12, 2001.
Nagahama H., Hatakeyama S., Nakayama K., Nagata M., Tomita K., Nakayama K.
Spatial and temporal expression patterns of the cyclin-dependent kinase (CDK) inhibitors p27Kip1 and p57Kip2 during mouse development.
Anat. Embryol., 203: 77-87, 2001.
Sato N., Mizumoto K., Nakamura M., Maehara N., Minamishima YA., Nishio S., Nagai E., Tanaka M.
Correlation between centrosome abnormalities and chromosomal instability in human pancreatic cancer cells.
Cancer Genet. Cytogenet., 126: 13-9, 2001.
Kamizono S., Hanada T., Yasukawa H., Minoguchi S., Kato R., Minoguchi M., Hattori K., Hatakeyama S., Yada M., Morita S., Kitamura T., Kato H., Nakayama Ki., Yoshimura A.
The SOCS box of SOCS-1 accelerates ubiquitin-dependent proteolysis of TEL-JAK2.
J. Biol. Chem., 276: 12530-8, 2001.
Kamura T., Burian D., Khalili H., Schmidt SL., Sato S., Liu WJ., Conrad MN., Conaway RC., Conaway JW., Shilatifard A.
Cloning and characterization of ELL-associated proteins EAP45 and EAP20. a role for yeast EAP-like proteins in regulation of gene expression by glucose.
J. Biol. Chem., 276: 16528-33, 2001.
Ageta H., Kato A., Hatakeyama S., Nakayama K., Isojima Y., Sugiyama H.
Regulation of the level of Vesl-1S/Homer-1a proteins by ubiquitin-proteasome proteolytic systems.
J. Biol. Chem., 276: 15893-7, 2001.
Morishita H., Makishima T., Kaneko C., Lee YS., Segil N., Takahashi K., Kuraoka A., Nakagawa T., Nabekura J., Nakayama K., Nakayama KI.
Deafness due to degeneration of cochlear neurons in caspase-3-deficient mice.
Biochem. Biophys. Res. Commun., 284: 142-9, 2001.
Xiang Z., Ahmed AA., Moller C., Nakayama KI., Hatakeyama S., Nilsson G.
Essential role of the prosurvival bcl-2 homologue A1 in mast cell survival after allergic activation.
J. Exp. Med., 194: 1561-70, 2001.
Kiernan RE., Emiliani S., Nakayama K., Castro A., Labbe JC., Lorca T., Nakayama Ki. K., Benkirane M.
Interaction between cyclin T1 and SCF(SKP2) targets CDK9 for ubiquitination and degradation by the proteasome.
Mol. Cell. Biol., 21: 7956-70, 2001.
Ikeda H., Yoshimoto T., Shida N., Miyoshi I., Nakayama K., Nakayama K., Oshima M., Taketo MM.
Morphologic and molecular analysis of estrogen-induced pituitary tumorigenesis in targeted disruption of transforming growth factor-beta receptor type II and/or p27 mice.
Endocrine, 16: 55-65, 2001.
Maruyama S., Hatakeyama S., Nakayama K., Ishida N., Kawakami K., Nakayama K.
Characterization of a mouse gene (Fbxw6) that encodes a homologue of Caenorhabditis elegans SEL-10.
Genomics, 78: 214-22, 2001.
Doira N., Kanematsu T., Matsuda M., Takeuchi H., Nakano H., Ito Y., Nakayama K., Nakayama KI., Hirata M.Hyperinsulinemia in PRIP-1 gene deleted mice.
Biomed. Res., 22: 157-65, 2001.
No. 1, Times Cited: 1343.
Nakayama K., Ishida N., Shirane M., Inomata A., Inoue T., Shishido N., Horii I., Loh DY., Nakayama KI.
Mice lacking p27(Kip1) display increased body size, multiple organ hyperplasia, retinal dysplasia, and pituitary tumors.
Cell, 85: 707-20, 1996.
No. 2, Times Cited: 976.
Nakayama KI., Nakayama K.
Ubiquitin ligases: cell-cycle control and cancer.
Nature Rev. Cancer, 6: 369-81, 2006.
No. 3, Times Cited: 602.
Nakayama K., Nagahama H., Minamishima YA., Matsumoto M., Nakamichi I., Kitagawa K., Shirane M., Tsunematsu R., Tsukiyama T., Ishida N., Kitagawa M., *Nakayama KI., Hatakeyama S.
(*Corresponding author)
Targeted disruption of Skp2 results in accumulation of cyclin E and p27(Kip1), polyploidy and centrosome overduplication.
EMBO J., 19: 2069-81, 2000.
No. 4, Times Cited: 532.
Yada M., Hatakeyama S., Kamura T., Nishiyama M., Tsunematsu R., Imaki H., Ishida N., Okumura F., Nakayama K., Nakayama KI.
Phosphorylation-dependent degradation of c-Myc is mediated by the F-box protein Fbw7.
EMBO J., 23: 2116-25, 2004.
No. 5, Times Cited: 444.
Kitagawa M., Hatakeyama S., Shirane M., Matsumoto M., Ishida N., Hattori K., Nakamichi I., Kikuchi A., Nakayama KI., Nakayama K.
An F-box protein, FWD1, mediates ubiquitin-dependent proteolysis of beta-catenin.
EMBO J., 18: 2401-10, 1999.
No. 6, Times Cited: 417.
Takai H., Tominaga K., Motoyama N., Minamishima YA., Nagahama H., Tsukiyama T., Ikeda K., Nakayama K., Nakanishi M., Nakayama KI.
Aberrant cell cycle checkpoint function and early embryonic death in Chk1(-/-) mice.
Genes Dev., 14: 1439-47, 2000.
No. 7, Times Cited: 416.
Hatakeyama S., Yada M., Matsumoto M., Ishida N., Nakayama KI.
U box proteins as a new family of ubiquitin-protein ligases.
J. Biol. Chem., 276: 33111-20, 2001.
No. 8, Times Cited: 377.
Nakayama KI., Nakayama K., Negishi I., Kuida K., Shinkai Y., Louie MC., Fields LE., Lucas PJ., Stewart V., Alt FW., Loh DY.
Disappearance of the lymphoid system in Bcl-2 homozygous mutant chimeric mice.
Science, 261: 1584-8, 1993.
No. 9, Times Cited: 357.
Nakayama K., Nakayama KI., Negishi I., Kuida K., Sawa H., Loh DY.
Targeted disruption of Bcl-2 alpha beta in mice: occurrence of gray hair, polycystic kidney disease, and lymphocytopenia.
Proc. Natl. Acad. Sci. U.S.A., 91: 3700-4, 1994.
No. 10, Times Cited: 325.
Kamura T., Hara T., Matsumoto M., Ishida N., Okumura F., Hatakeyama S., Yoshida M., Nakayama K., Nakayama KI.
Cytoplasmic ubiquitin ligase KPC regulates proteolysis of p27(Kip1) at G1 phase.
Nature Cell Biol., 6: 1229-35, 2004.

研究費獲得状況
※ 現在取得中のもの
中山 敬一 教授
戦略的創造研究推進事業(CREST)
H9~H14 脳を守る「神経細胞における増殖制御機構の解明」
H14~H19 生命の発生・分化・再生「細胞周期の再活性化による再生能力の賦活化の研究」
H19~H24 生命システムの動作原理の解明と活用のための基盤技術の創出「ユビキチンシステムの網羅的解析基盤の創出」
シーズイノベーション推進事業
H18~H19 育成ステージ「ユビキチン化酵素の阻害による新規抗肥満薬の開発」
科学研究費補助金
H9~H10 基盤研究(B)「PKCδノックアウトマウス作成による細胞死(アポトーシス)シグナル伝達系の研究」
H11~H12 基盤研究(B)「神経変性疾患における封入体物質のユビキチン化に関わる因子の単離同定と解析」
H12~H16 特定領域研究(計画班)発がんと発がん防御の基礎的研究「細胞周期抑制分子p27の分解機構の研究」
H13~H14 基盤研究(B)「ポリグルタミン病における異常タンパク質の新規クリアランスシステムの研究」
H15~H16 基盤研究(B)「発生工学プロテオミクスを用いたPKC-δシグナル伝達系の解明」
H17~H21 基盤研究(S)「神経突起形成のマスター分子Protrudinの発見と機能解析」
H17~H21 特定領域研究(計画班)遺伝情報システム異常と発がん「タンパク質分解異常による発がん機構の研究」
H22~H24 基盤研究(A)「小胞輸送制御分子プロトルーディンの神経機能における役割の解明」
H22~H26 新学術領域研究(研究領域提案型)「癌幹細胞の細胞周期制御機構の解明と治療法の開発」
H25 挑戦的萌芽研究「自閉症スペクトラムの原因候補遺伝子の機能解析」
H26 挑戦的萌芽研究「次世代プロテオミクスを用いたがんにおけるワールブルグ効果の根本的な解明」
H25~H29 基盤研究(S)「幹細胞維持分子の機能解析と全身の幹細胞の可視化を目指した総合的研究」
H27 挑戦的萌芽研究「栄養シグナルと炎症を結ぶ新規シグナル伝達経路の解明」
H29~H33 *特別推進研究採択に伴い、H30.4.22付けで廃止 新学術領域研究(研究領域提案型)「がん細胞の代謝アダプテーション」
H30~R4 特別推進研究「幹細胞における細胞周期の制御と代謝系との連関に関する総合的研究」
R5~R7 基盤研究(A)「幹細胞における時空間リプログラミングの機構解明と疾患との関わりの研究」
厚生労働科学研究費補助金
H25 第3次対がん総合戦略研究事業「癌転移能を規定する宿主側のユビキチン化機構の解明」
H26 革新的がん医療実用化研究事業「膵癌症例の術後転移再発抑制を目差した慢性肝炎治療薬3-オキシゲルミルプロピオン酸重合体を用いた臨床治験に関する研究」
次世代がん研究シーズ戦略的育成プログラム(P-DIRECT)
H23~H26 がん関連遺伝子産物の転写後発現調節を標的とした治療法の開発「がんの増殖を制御するユビキチン化酵素群を標的とする治療薬の開発」
AMED(国立研究開発法人日本医療研究開発機構)
H27(H26より引き続き) 厚生労働科学研究委託費(革新的がん医療実用化研究事業)「膵癌症例の術後転移再発抑制を目差した慢性肝炎治療薬3-オキシゲルミルプロピオン酸重合体を用いた臨床治験に関する研究」
H27(H26より引き続き) 科学技術試験研究委託事業(次世代がん研究シーズ戦略的育成プログラム)「がん関連遺伝子産物の転写後発現調節を標的とした治療法の開発」
H28.5.25〜R4.3.31 次世代がん医療創生研究事業「FOXK1によるCCL2発現調節機構を標的としたがん治療法の開発」
H29.1.1〜R4.3.31 創薬支援推進事業(厚労省)「癌代謝制御ハブ分子の新規阻害剤の探索」
R4.10.1〜R5.3.31 創薬支援推進事業・創薬総合支援事業「がん幹細胞を標的とした薬剤の探索」
R3.7.1〜R7.3.31 脳とこころの研究推進プログラム(精神・神経疾患メカニズム解明プロジェクト)「自閉スペクトラム症の分子的機序に関する研究開発」
R5.4.1〜R8.3.31 革新的がん医療実用化研究事業「難治性がんを標的とした代謝酵素阻害薬の創出」
九州大学教育研究プログラム・研究拠点形成プロジェクト
H25〜H26 九州大学COE研究「次世代プロテオミクスと数理情報科学の融合によるネットワーク創薬研究拠点の形成」
民間グラント(500万円以上)
H8 東レ科学技術研究助成「神経再生に関する基礎的研究と脳移植への応用」
H12~H14 Human Frontier Science Program「Molecular analysis of the SCF ubiquitin ligase from yeast to human」
H15 三菱財団自然科学研究助成「細胞増殖抑制分子p27の分解機構の研究」
H18 上原記念生命科学財団研究助成金「細胞周期からの脱出と再進入に関わるユビキチンリガーゼ群の研究」
H19 武田科学振興財団研究助成・特定研究助成[I]「幹細胞における増殖分化決定機構の解明と癌幹細胞への応用」
比嘉 綱己 プロジェクト助教
科学研究費補助金
R5~R6 若手研究「p57系等追跡と1細胞解析を用いた条件誘導型幹細胞の網羅的探索と脱分化機構の解明」

賞状
2005年度
Shirokane International Symposium
Young Investigator Award
白根 道子

第一回目の附置研究所合同シンポジウムで、他研究所の人に自分の研究を紹介し評価を頂き、大変有意義でした。震度5の地震が来て、医科研の講堂が揺れたのが印象的でした。賞の5千円が白金から羽田のタクシー代に変わってしまい、ちょっと残念でした。
特定領域研究 「タンパク質の一生」
ポスター優秀賞
中川 直

淡路島で行われた第七回「タンパク質の一生」国際会議においてポスター賞を頂きました。ポスター賞があることすら知らなかったので、受賞に吃驚したことと、急な口頭発表のために、一晩で12分間の英語原稿を必死に書いたことを覚えています。ポスター賞の有無に関わらず、世界中から集まった著名な研究者達の発表を直接聞け、大変有意義な学会でした。
生医研リトリート
口頭発表 優秀賞
小野山 一郎

リトリートの発表は教授をはじめ先輩、後輩みんなが揃って見ているので緊張しました。当然中山研所属の人からは質問は出ませんが、他の研究室の方々から色々質問されたので、自分の発表がある程度理解してもらえたのではないかとホッとしました。
生医研リトリート
ポスター発表 優秀賞
西山 正章

チョ〜気持ちいい。鳥肌もんっす。
生医研リトリート
ポスター発表 優秀賞
洲崎 悦生

データが集まり始めたばかりの仕事でしたが、何とか賞に食い込むことができました。今度はぜひ一番を取りたいですね。
2006年度
生医研リトリート
口頭発表 優秀賞
洲崎 悦生

大学院に入って初めてのオーラルでしたが、結構いい感じだったと思います。残念ながらトップを逃してしまいました。後輩の奮起を期待します。
生医研リトリート
ポスター発表 最優秀賞
松本 有樹修

とにかくがむしゃらでした。ただそれだけです。
2007年度
The Joint Symposium of the 3rd International Symposium of Institutes Network and Hot Spring Harbor-Global COE Symposium
Young Investigator Award
西山 正章

なんも言えねぇ。アテネの時より気持ちいい。最高っすね。
生医研リトリート
口頭発表 優秀賞
田中 佳苗

発表準備の際、最も印象的だったのが、「話に枝葉をつけるな、聴き手が混乱するから」という中山教授の言葉でした。実際、私の発表も何か所も削られました。発表当日、「話が解り易かった」と知らない学生さんから言われ、また優秀賞に選ばれたことで、その言葉の意味を理解しました。これからも、誰にでも解り易い発表ができれば、と思います。
生医研リトリート
ポスター発表 優秀賞
細田 將太郎

初めてのポスター発表でしたが、目の前の相手に上手く実験内容を説明するということ、質問を受けるということの難しさを経験するいい機会になりました。前日の深夜まで同級生の山田君と質問対策をしたおかげで賞をとることができました。これを励みに頑張ります。
2008年度
生医研リトリート
口頭発表 最優秀賞
松本 有樹修

ポスターでも金、口演でも金。いろんな人の支えがあってのものです。次は外に目を向けて頑張ります。
生医研リトリート
ポスター発表 優秀賞
松崎 芙美子

ポスター発表のチャンスを下さった先生方や、内容・構成のアドバイスを下さった先輩方に報いることができてよかったです。また、発表を通して他の研究室の方々と交流を深めることができ、とても楽しかったです。
The Joint Symposium of the 4th International Symposium of Institutes Network and Osaka University Global COE
Young Investigator Award
松本 有樹修

優秀な方々がたくさんいる中で、賞に選んで頂けたことは非常に光栄です。 今後も、もっと多くの人に感動を与えるような研究をしていきたいです。
2009年度
生医研リトリート
口頭発表 最優秀賞
松崎 芙美子

賞を頂いた心境としては、喜びよりも責任を果たせたことへの安堵の方が大きいです。しかし、自分の研究へのレスポンスを得られたことは、良くても悪くても、大変大きな喜びでした。ご指摘・ご質問を下さった方々、ありがとうございました。(そして、あまり適確に答えられなくて申し訳ありませんでした。)
生医研リトリート
ポスター発表 最優秀賞
松本 有樹修

また賞を頂くことができ、非常に光栄です。今回は様々な先生が研究者としてのアドバイスなどをして下さり、貴重な時間を過ごすことが出来ました。
2010年度
生医研リトリート
ポスター発表 優秀賞
諸石 寿朗

少しずつ積み上げていった研究成果を、たくさんの方に共感して頂けて非常に嬉しいです。これを励みによりいっそう頑張ります。
第50回 生命科学夏の学校
Best question賞
細田 將太郎

この度、講演での質問が評価される珍しい賞を頂けました。質問することは、相手の研究内容をよく理解するだけでなく、発表者をおもてなしする心ということを忘れずに今後もどんどん質問していきたいと思います。
平成22年度 がん若手研究者ワークショップ
最優秀演者
蟹江 共春

中山研に入って、初めてのオーラルでした。素晴らしい発表ばかりの中、自分なんかが選ばれて良いのだろうかと恐縮してしまいました。これに恥じぬよう、精進していきたいと思います。
平成22年度 個体レベルでのがん研究支援活動ワークショップ
ベストディスカッサー賞
沖田 康孝

積極的に討論したということで、ベストディスカッサー賞という賞を頂くことができました。相手のことをより深く理解するために質問をするという姿勢が身についてきたのかなと思いました。これからも積極性を忘れず討論に参加したいと思います。
The Joint Symposium of the 7th Global-COE International Symposium and 6th Young Investigators Forum
Young Investigator Award (Oral)
諸石 寿朗

初めての海外での口頭発表でしたが、賞に選んでもらえて非常に嬉しいです。たくさんの方々の支えがあってのことですので、これからももっといい研究が出来るように頑張ります。
The Joint Symposium of the 7th Global-COE International Symposium and 6th Young Investigators Forum
Young Investigator Award (Poster)
沖田 康孝

重要なデータに絞るという作業はとても難しく出発の前日までポスターの構成の変更を行うなど大変でしたが、アドバイスを頂いた先生方や先輩方に報いることができてよかったです。
2011年度
生医研リトリート
口頭発表 最優秀賞
諸石 寿朗

面白い発表がたくさんあった中で、賞に選んでもらえて大変光栄です。発表終了後に、多くの人から発表が分かりやすかったと声をかけてもらえ、とても嬉しく思いました。これを励みに、今後も重要な研究ができるように頑張りたいと思います。
生医研リトリート
ポスター発表 優秀賞
細田 將太郎

数多くの素晴らしいポスターの中から賞を頂き非常に光栄です。ポスターを聞きに来てくださった方々に感謝します。この賞に満足することなく研究に励みたいと思います。
2012年度
The 7th International Symposium of Institute Network
Young Investigator Award
諸石 寿朗

このような賞を頂くことができて大変光栄です。発表の機会を多く頂いたので、英語の口頭発表にもだいぶ度胸がついてきました。発表を通じて多くの方とディスカッションができ、とても嬉しく思いました。
第16回日本がん分子標的治療学会学術集会
優秀ポスター賞
舟崎 慎太郎

修士時代の成果ですが、努力したものがこうして評価していただけるのは嬉しいです。色々な面でまだまだと思うので、これを糧に素晴らしい研究ができるように精進していきたいと思います。
生医研リトリート
口頭発表 最優秀賞
細田 將太郎

このような素晴らしい賞を頂けて大変光栄です。発表後に多くの質問を頂けたことが何よりもうれしかったです。今後も、この経験を糧に頑張ります。
生医研リトリート
ポスター発表 優秀賞
中津海 洋一

たくさん発表がある中で賞をいただき非常に光栄です。多くの先生方との議論から今後の研究で詰めるべきポイントが浮き上がり、また新たな視点で研究を眺めることができました。楽しい時間を過ごせたことに感謝したいです。
2013年度
The 8th International Symposium of Institute Network
Best Poster Award
中津海 洋一

多くの発表の中で賞に選んでいただき光栄でした。オープンな研究発表の場で賞を頂くのは初めての経験でしたし、また出身校での開催だったので母校に錦を飾った気がして嬉しかったです。今後も頑張っていきたいです。
生医研リトリート
口頭発表 最優秀賞
中津海 洋一

めちゃくちゃ緊張しましたが、頑張った甲斐があって賞を頂きました。リトリートの口演賞は別格です。嬉しいです。
生医研リトリート
ポスター発表 最優秀賞
片山 雄太

このような賞を頂き光栄です。多くの先生方と議論させて頂き、興味をを持って頂けたことはとても励みになりました。この研究を更に深めていけるよう精進していきたいと思います。
第25回高遠・分子細胞生物学シンポジウム
ポスター発表 最優秀賞
中津海 洋一

歴史ある高遠シンポジウムで最優秀賞を頂けまして、本当に光栄です。僕が大学院生のころ高遠シンポジウムに初めて参加したときには、すごい研究者がズラッと揃っていて、その研究の内容にも衝撃の連続でした。憧れだったこのシンポジウムで賞を頂けたことは、本当に嬉しく思います。
The Joint Symposium of the 23rd Hot Spring Harbor International Symposium and the 3rd ‘Grants for Excellent Graduate Schools’ International Symposium
Outstanding Poster Award
西山 正章

じぇじぇじぇ!(‘ jjj ‘)/
2014年度
The 9th International Symposium of Institute Network
Best Poster Award
片山 雄太

著明な先生方に興味を持って頂けたことが何よりの喜びです。これまでの発表時とは異なった視点からの質問やご助言も多数頂き、自分の研究を再考する良い機会にもなりました。
生医研リトリート
口頭発表 優秀賞
片山 雄太

口頭発表で初めて賞を頂きました。限られた時間の中で相手に伝えることの難しさを痛感しました。しかし発表後におもしろかったと言って頂けたことがとても嬉しく、自信にもなりました。
生医研リトリート
ポスター発表 優秀賞
弓本 佳苗

多くの方に発表を聞いてもらうことができ、また、重要なコメントをたくさん戴くことができ、とても感謝しています。さらによりよい研究になるよう、頑張ります。
生医研リトリート
ポスター発表 優秀賞
喜多 泰之

少しポスターに遊び心をちりばめすぎた気はしますが、多くの方が興味を持ち説明を聞きにきて下さり、とても嬉しかったです。今回の内容が、もっと厚みのある面白い研究になるよう、頑張ります。
井上科学振興財団
第31回井上研究奨励賞
武石 昭一郎

このような栄誉ある賞をいただき、大変光栄です。今回の受賞はひとえに先輩方のご指導と、よき同僚に恵まれたおかげと感謝しています。これを励みに今後も一層努力します。
がん若手研究者ワークショップ
ベストディスカッサー賞
武藤 義治

積極的に討論したということで、ベストディスカッサー賞という賞を頂くことができました。相手のことをより深く理解するために質問をするという姿勢が身についてきたのかなと思いました。これからも積極性を忘れず討論に参加したいと思います。
2015年度
生医研リトリート
優秀口演賞
喜多 泰之

自分の英語能力の低さを露呈してしまい、ほろ苦い口演デビューになりましたが、、、非常に良い経験をさせて頂きました。発表後には、多くの方々から「面白かった」と声をかけて頂き、嬉しかったです。この賞に恥じぬよう、今後も精進していきたいと思います。
The 10th International Symposium of Institute Network
Best Poster Award
弓本 佳苗

大学一年生の、(しかも工学部や農学部の!)うら若き学生さん達に話を聞いてもらう機会を得ました。qRT-PCR?何それ?な世界です。コアながん研究の内容がちゃんと伝わったかどうかはわかりませんが、真剣に聞いてもらって、質問もいっぱいしてもらって、良い時間を過ごせたなと思います。
第38回日本分子生物学会年会、第88回日本生化学会大会 合同大会
若手優秀発表賞
川村 敦生

初めての口頭発表で緊張しましたが、とても良い経験になりました。これからも頑張ります。
2016年度
生医研リトリート
最優秀口演賞
比嘉 綱己

大変貴重な経験をさせていただき、ありがとうございました。当日いただいたご質問やアドバイスはすべてがクリティカルで、今後の研究に活かしていかねばならないと強く感じました。また、不器用な私に匙を投げることなく、連日にわたって丁寧なご指導をしてくださった中山先生には、感謝の念に堪えません。より説得力のある研究になるよう今後も頑張ります。
生医研リトリート
優秀ポスター賞
大西 隆史

学生として最後のリトリートで賞を頂けてとても嬉しいです。多くの先生、学生、留学生と話すことが出来て、とても密度の濃い時間を過ごすことが出来ました。選んで頂いた賞に恥じぬよう、また後輩に良い刺激を与えられるよう、精進していきます。
生医研リトリート
優秀ポスター賞
川村 敦生

多くの先生方と議論させていただき、とても良い機会になりました。同級生に最優秀賞を取られてしまったので、次は負けないように頑張ります。
平成28年度 生命科学科ポスター発表会
ベストプレゼンテーション賞
白石 大智

中山研の看板を背負った小さな初舞台、有言実行の精神でもぎ取りました。西山さん、喜多さんをはじめとする6研の皆さんからのアドバイスと応援、教授直々の応援とプレッシャーが無ければ、到底「実行」はできませんでした。このページに自分の名前が載るのは大変恐縮ですが、Mr.中山研を目指してこれからも頑張ります!
第39回 日本分子生物学会年会
優秀ポスター賞
中津海 洋一

分子生物学会で賞をいただくことができました。大変光栄です。多くの先生方との議論から様々な意見を頂きました。今後の研究の励みにしたいです。
第39回 日本分子生物学会年会
優秀ポスター賞
大西 隆史

ポスター賞に選んで頂いてとても光栄に思います。多くの先生方と自分の研究について議論できる学会は非常に楽しい場であり、そこで頂いた意見は研究の励みになります。良い発表を続けられるよう、研究と発表技術の向上に精進していきます。
第39回 日本分子生物学会年会
優秀ポスター賞
仁田 暁大

中山研ではポスター賞は当然かもしれませんが、個人的には初めてのポスター賞を頂いたので嬉しいです。これからもっといい研究ができるよう頑張ります。
第19回 武田科学振興財団生命科学シンポジウム 慢性炎症:機序と制御
Excellent Poster Award
中津海 洋一

免疫学のトップサイエンティストが集まるシンポジウムでポスター賞を頂きました。身に余る光栄です。今後とも研究に励んでいきます。
第90回日本薬理学会年会優秀発表賞
Young Investigator Outstanding Oral Presentation Award
南嶋 洋司

タイトルに“young”が付いた賞の、オーバーエイジ枠で受賞させて戴きました。学会賞の受賞は初めてだったということもあり、選んでいただいて素直に喜んでおります。今後の励みにしたいと思います。
2017年度
第69回日本細胞生物学会大会
若手最優秀発表賞
松本 有樹修

豪華な副賞があったり授賞式で鏡開きをしたりと、受賞後もサプライズがあり楽しかったです。今回は留学中の成果で賞を頂いたので、次は日本で出した成果で賞が頂けるよう頑張ります。
生医研リトリート
最優秀口演賞
川村 敦生

初めて英語で発表しましたが、とても良い経験になりました。発表のあと、いろいろな方から研究について聞かれたり面白かったと言っていただき嬉しかったです。また、ご指導して下さった中山先生やアドバイスを下さった方々には本当に感謝しております。これからも頑張ります。
生医研リトリート
最優秀ポスター賞
武藤 義治

いろいろな先生方とディスカッションをして頂き、有益な時間を過ごすことができました。
生医研リトリート
優秀ポスター賞
仁田 暁大

第20回目という節目のリトリートで、4冠達成に貢献できたことは大変嬉しく思います。助けて頂いた先輩や有意義なディスカッションをして下さった先生方には非常に感謝しています。これを励みにより一層の精進し、面白い研究を全力でしたいと思います!
日本プロテオーム学会2017年大会(JHUPO第15回大会)
平成29年度日本プロテオーム学会賞
松本 雅記

これまでの一連のプロテオミクス研究に対して学会賞をいただきました。iMPAQTの論文が主な業績となったので2重に嬉しい受賞となりました。今後もプロテオーム研究にさらに励んでいきたいと思います。
The 12th International Symposium of Institute Network
Poster Award
比嘉 綱己

まさか賞に選んでいただけるとは思ってもいなかったので、びっくりしました。全国各地の研究所の先生方から貴重なサジェスチョンをいただけたことが、なによりも嬉しかったです。恥じないよう今後も精進いたします。
2017年度九州大学医学博士
優秀賞
片山 雄太

3年前に始まった賞で、その後約300人の学位取得者のうち4人目の受賞とのことでした。中山先生のご指導あってのものですが、自分の努力を認めて貰えた気がして嬉しかったです。今後はこれを励みに益々頑張りたいと思います。
2018年度
生医研リトリート
最優秀口演賞
清水 秀幸

とても立派な賞をいただき大変光栄です。中山研の長い歴史あっての受賞です。これからも頑張ります。
生医研リトリート
優秀ポスター賞
比嘉 綱己

面白い研究がたくさんあった中で賞に選んでいただけてとても嬉しかったです。あとはすべてのデータを1日も早く形にできるよう頑張ります。
生医研リトリート
優秀ポスター賞
白石 大智

日頃からご助力頂いている多くの方と、自分の拙い説明を熱心に聞いて下さった先生方に感謝です。もっともっと頑張ります。まだまだこんなもんじゃないっす。
日本学術振興会 平成29年度特別研究員等審査会
専門委員 書面担当 表彰
弓本 佳苗

これも、ジャーナルクラブでの鍛錬のお陰、、、なのでしょうか?
次世代脳プロジェクト 冬のシンポジウム2018
若手優秀発表賞
片山 雄太

第一線で活躍されている先生方からご助言をいただける大変貴重な機会でした。これを励みにより一層頑張りたいと思います。
2019年度
生医研リトリート
最優秀質問賞
比嘉 綱己

正直どうして自分がいただけたのかわからず恐縮ですが、発表の賞とはまた違う嬉しさを感じています。いつか英語でもすらすらと的確なディスカッションができるようになりたいです。
生医研リトリート
最優秀質問賞
立石 千瑳

拙い英語の質問で恥ずかしい部分はありましたが、中山先生の「1人1個は質問をしよう」の言葉に背中を押して頂き、結果的にこのような賞を頂けてとても光栄でした。これからも積極的に取り組めたらいいなと思います。
生医研リトリート
優秀口演賞
小玉 学

分子医科学という看板を背負っての口頭発表、しかも英語で、、、非常に重圧と責任を感じましたが、良い経験になりました。今回の経験をもとに、今後につなげたいと思います。
生医研リトリート
優秀ポスター賞
見世 慎太朗

多くの先生方にアドバイスをいただくことができて、とても感謝しています。つぎはもっと上に。
生医研リトリート
優秀ポスター賞
立石 千瑳

取れる自信はありませんでしたが、ガムシャラに日頃の成果を出し切って 「奪sh!」しました。まだまだ上を目指してもっともっと頑張ります。
新学術領域「マルチスケール精神病態の構成的理解」第二回領域会議
若手優秀発表賞
白石 大智

全ての発表に質問する強者が参加しており、刺激を受けました。このような経験を忘れずに頑張っていきたいと思います。
新学術領域研究「数理シグナル」第三回若手ワークショップ
優秀討論賞
立石 千瑳

全ての発表に質問する強者が参加しており、刺激を受けました。このような経験を忘れずに頑張っていきたいと思います。
2020年度
The 15th International Symposium of Institute Network
Early Career Investigator Award (Oral)
小玉 学

生体防御医学研究所から若手部門代表で発表させていただき、その結果賞を取れたのでよかったなと思います。英語での口演発表も今回で2回目の経験なので、だんだん慣れてきた気がします。今後は海外での学会で十分に口演発表と質疑ができるようにならなくては、と感じさせるいい経験となりました。
2021年度
生医研リトリート
最優秀口演賞
見世 慎太朗

この研究にご助力いただいた多くの先生方に感謝いたします。これからも頑張っていきたいと思います。
2022年度
生物工学若手研究者の集い オンラインセミナー2022
Active discussion award
白石 大智

普段馴染みの無いユニークな研究の数々に、質問欲が止まりませんでした。夫婦揃っての受賞だったことも嬉しいです。これからも「もっと!もっと!もっと!」賞が取れるように頑張ります。
生物工学若手研究者の集い オンラインセミナー2022
Active discussion award
白石 千瑳

同年代の研究者の発表が聞けてとても刺激を受けました。負けずに頑張りたいです。
生医研リトリート
最優秀口演賞
白石 千瑳

リトリートのオーラルという大役を任されプレッシャーもありましたが、一番最高の結果となり大変嬉しいです。先生方のご指導のもと入念に発表準備を行ったことは、今後に繋がる良い経験になったと思います。また、発表後はたくさんの方々にお褒めの言葉をいただき、自分への自信にもつながりました。
生医研リトリート
最優秀質問賞
白石 大智

同期2人の口演発表に負けじと頑張った結果、念願のリトリート質問賞をようやく取ることができました。常連になれるようにこれからも日々鍛錬します。
生医研リトリート
最優秀ポスター賞
市原 知哉

白石さん共々、チームの成果を評価して貰えたことが何より嬉しいです。面白いと言ってくださった方、有益な助言をくださった方、ご指導くださった先生方にただ感謝しています。
生医研リトリート
優秀ポスター賞
和田 玲緒名

多くの面白い研究発表がある中で、優秀ポスター賞を賜り、中山研の4冠達成に貢献できたことを光栄に思います。これもひとえに中山研の皆様のお力添えのおかげです。誠にありがとうございました。
2023年度
生医研リトリート
最優秀ポスター賞
白石 大智

修士1年の時に取り逃がした最優秀賞を最後に取れてよかったです。日々の飲み会コネクションの大事さを(はじめて?)実感しました。これからも賞を貪欲に狙う姿勢を磨いていきたいと思います。
生医研リトリート
優秀口演賞
須賀原 修

自前のネタで受賞できたことを嬉しく思います。中山先生に本番前日までご指導頂いた甲斐あって、多くの方から面白かったと反応を頂きました。今回の経験を活かして、一層精進いたします。
生医研リトリート
最優秀質問賞
湊 隆文

先輩方が沢山質問している姿を見てカッコいいなと思い、私自身も、内容はともかく何かしら質問をしてみようと思い質問してみた結果、この様な素晴らしい賞を頂けたことに大変驚き、そして嬉しく思います。次はもっとキレのある質問を出せるように鍛錬していきたいと思います!
生医研リトリート
優秀ポスター賞
湊 隆文

ポスター作製の過程を通して、自分にとっては当たり前の知識だけど、 他の人は全く知らないという話をいかに一目で伝えるのかという事の難しさ、重要性を学びました。私のメチャメチャな初版のポスターから比嘉さんと中山先生の指導を通して改善していく中でそのポイントを学ばせていただけた事に大変感謝致します!私の拙い発表に投票して下さった方々にも厚く御礼申し上げます
九州大学伊藤早苗賞
九州大学 若手女子大学院生 優秀研究者賞
白石(立石) 千瑳

名誉ある賞を受賞でき、自信になりました。頂いた賞に恥じぬように研究をしていこうと思います。
2024年度
ロレアルーユネスコ女性科学者
日本奨励賞
白石(立石) 千瑳

この度、大変名誉ある賞をいただけて、本当に驚きと喜びで胸がいっぱいです。この受賞をいただけたのも、中山先生からの研究や学会発表についてのご指導、そして質疑応答に積極的に参加することの大切さを教えていただいたおかげだと思っています。ラボの皆様にも心から感謝しております。今後も研究に励み、皆様のご期待に応えられるよう一層努力してまいります。

設備
ただいま準備中です。

個別トピックス

TV報道・番組
- 2013年3月19日 NHKニュース
- 2013年9月8日 NHK サイエンスZERO
- 2013年9月19日 NHK クローズアップ現代
- 2016年9月8日 NHKニュース
- 2018年9月27日 NHKニュース
- 2018年9月27日 NHKほっと関西
2013年3月19日 NHKニュース
“がん作る細胞”に効果
2013年9月8日 NHK サイエンスZERO
がん再発の謎が解けた!新発見「がん幹細胞」
2013年9月19日 NHK クローズアップ現代
がん“根治”の時代は来るか ~“がん幹細胞”研究最前線~
2016年9月8日 NHKニュース
自閉症などの発症 メカニズムを解明
2018年9月27日 NHKニュース
乳がん手術後の生存率“23遺伝子が深く関係”
2018年9月27日 NHKほっと関西
乳がん生存率に関係か 遺伝子23種類

Exit and Re-entry of the Cell Cycle

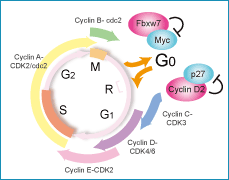
細胞周期は,G0からG1,S,G2,Mの各期を回る周期である。G0期は静止期と呼ばれ,細胞分化・老化・アポトーシスなどのさまざまな生命現象のゲートウェイとなる時期であると考えられている。G0期制御の破綻は癌などの深刻な疾患を引き起こす。しかしながら,細胞周期からG0期へのexit及びre-entryのメカニズムは長らく不明であった。
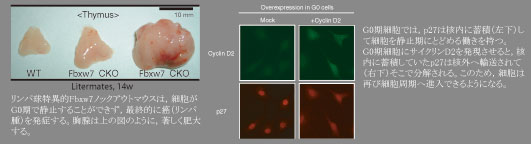
本年我々は,このG0期制御のメカニズムを提唱する論文を相次いで発表した。小野山らはユビキチンリガーゼの一つであるFbxw7がMycの分解を制御することにより,リンパ球の分化段階におけるG0期へのexit,およびre-entryに極めて重要な働きを担っていることを明らかにした (J.Exp.Med., 204:2875-2888, 2007) 。Fbwx7のリンパ球特異的ノックアウトマウスはリンパ球の分化に異常を来す。長期的にはリンパ腫を発症し,早期に死亡する。
一方,洲﨑らはG0-G1移行期における細胞周期の負の制御因子であるp27の分解メカニズムの一端を明らかにした。p27はG0期において核内に蓄積しCDK活性を抑制しているが,G0-G1移行期に細胞質へ移行しそこで分解を受ける。洲﨑らはこの輸送がG1早期サイクリンであるサイクリンD2に依存してることを明らかにし(Mol.Cell.Biol., 2007),これまで分かっている複数の核外移行パスウェイを統合した新しいモデルを提唱した(Cell Cycle,6:3015-3020,2007)。
以上の知見は,これまでほとんど踏み込まれてこなかったG0期制御のメカニズムの解明に向けた,大きな第一歩である。
