研究内容
私達は以下の5つのテーマを主に行っています
(ここに書いていないテーマもいっぱいやっています)
Research
01幹細胞の細胞周期制御メカニズム:全身の幹細胞の可視化に向けて
私たちの身体は、さまざまな構造・機能を持つ臓器(≒器官・組織)から構成されています。それぞれの組織において、すべての細胞を生み出すもとになっている細胞のことを「組織幹細胞」といいます。組織幹細胞は、組織全体のわずか0.001%という大変まれな細胞集団でありながら、数十年にも及ぶ寿命を持ち、特定の組織を一生涯にわたって維持する能力を有しています。
それぞれの組織ごとに特有の幹細胞が存在すると考えられていますが、多くの組織において、その正体はほとんど明らかにされていません。その理由としては、幹細胞の数がきわめて少ないことに加え、そもそも何を手掛かりにして幹細胞を探せばよいのか、いわば「組織幹細胞の目印」は何かということがほとんどわかっていないことが最大の要因といえます。
私たちは、組織幹細胞の大きな特徴である「静止状態(G0期)」に着目して研究を行ってきました。細胞が増殖するときには「細胞周期」にしたがって分裂を行うことで子孫の細胞を生み出していくことがよく知られていますが、組織幹細胞は長期にわたって細胞周期を停止し、あたかも冬眠しているような状態にあることがわかってきたのです。この静止状態にとどまることで、組織幹細胞は分裂に伴うストレスや老化を回避し、その性質を一生涯にわたって維持できると考えられます。
私たちはこれまでの研究において、静止状態の維持に重要な因子である「p57」という遺伝子が、血液・神経・腸管の幹細胞で非常に高レベルに発現していることを見出してきました。さらにノックアウトマウスを用いた実験から、p57は組織幹細胞を静止状態にとどめておくことで、幹細胞の維持に必須の役割を果たしていることを明らかにし、これらの発見は世界的にも高い評価を受けています。
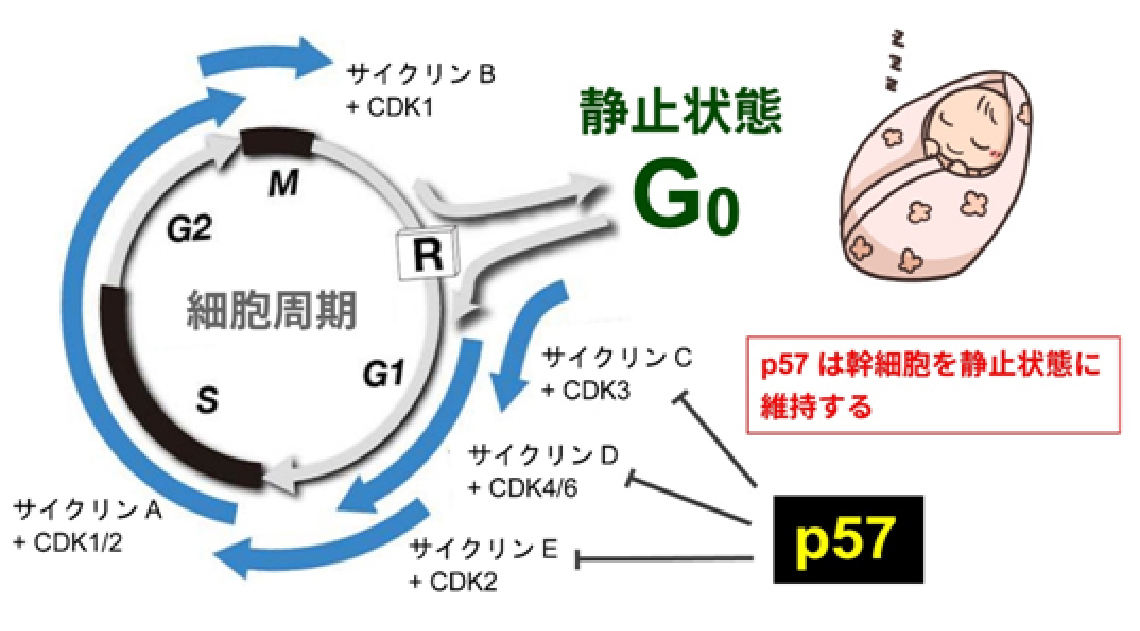
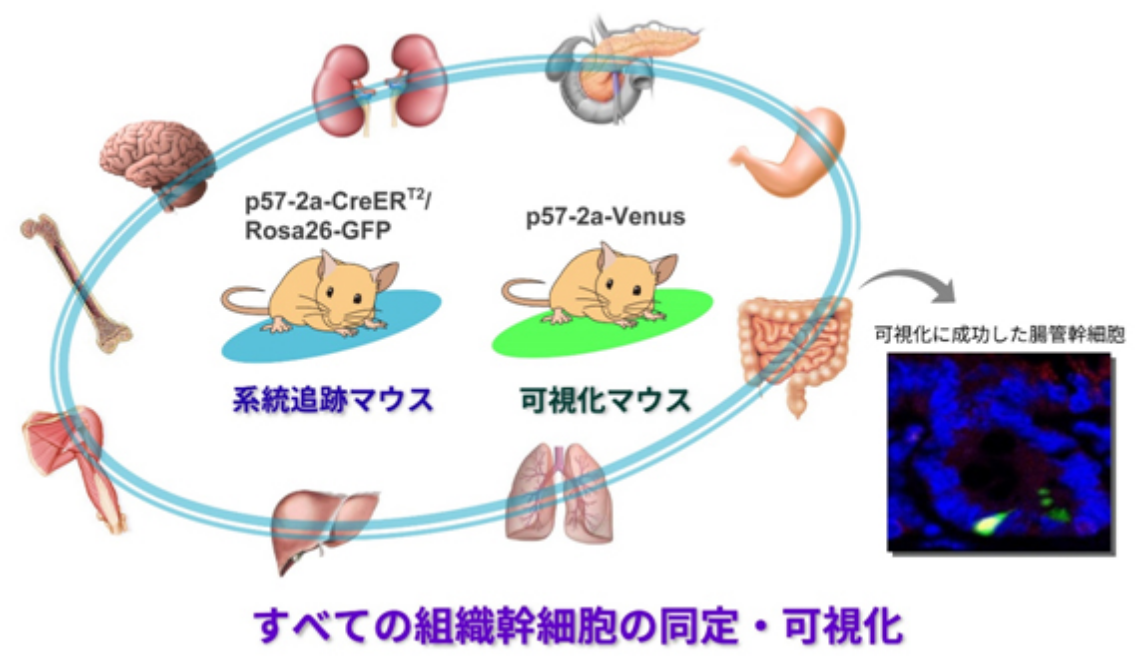
ここで大変興味深いのは、このp57は「幹細胞だけ」に発現し、他の細胞にはまったく発現していないという点です。さらに、その発現パターンと機能的な重要性は、血液・神経・腸管という最も研究が進んでいる3種類の組織幹細胞において共通しています。
この事実はすなわち、「p57を目印として用いれば、すべての組織において幹細胞を探し出すことができるのではないか」という可能性を強く示唆しています。最近、私たちはこの仮説に基づいて、以下の2種類の遺伝子改変マウスの作出に成功しました。
近い将来、これら2つのシステムを組み合わせることで、各組織の幹細胞の性質や挙動を生体内(in vivo)で理解することができるようになると考えています。
近年、iPS細胞の登場によって再生医療への道が開かれましたが、そもそも生体内に存在する組織幹細胞がよくわかっていないという事実は、その現実化を進めるうえで大きな障壁となっています。また、臨床医学最大のブラックボックスであるがんや老化といった現象も組織幹細胞の異常であることが予想されていますが、やはりその仕組みを解明するにはまず正常の幹細胞について詳細に理解することが不可欠です。現在の私たちの研究は、これらの問題を解決する糸口となると考えています。
Research
02がん幹細胞の根絶:がんの治療を180度転換する
65才以上の方の割合がまもなく3割に到達しようとしている今の日本で、ダントツの死因は何かお分かりですか?それは「がん」であり、日本人の2人に1人はがんに罹り、3人に1人はがんで死ぬ時代です。しかもがんの発症率は年齢の5乗に比例すると言われているので、高齢化が進めば今後ますますがんの患者さんが増えていくでしょう。若いみなさんも他人事でありませんね。
がんは細胞が勝手にどんどん増殖してしまう病気ですが、正常細胞を攻撃せずに、異常ながん細胞だけを狙い撃ちして治療することは現在もほとんど成功していません。現在の抗がん剤のほとんどは、増殖が速い細胞を殺す薬剤ですが、がん細胞にも増殖が遅い細胞がごく一部含まれていて、その細胞こそががんの親玉 (がん幹細胞) であることが近年わかってきました。つまり抗がん剤だけでは増殖の遅いがんの親玉は退治できず、これが再発の原因になるのです。これを専門用語を使ってまとめると、がん幹細胞が細胞増殖期から外れた静止期 (G0期) にいることで、がんの治療抵抗性が生じているということになります。
私たちは長年にわたって細胞増殖とユビキチン (不要になったタンパクにつけられる目印) を研究してきたので、その成果ががんの親玉退治に応用できないのかと思い、血液のがんの一種である慢性骨髄性白血病を題材に調べてみました。すると興味深いことに、がん幹細胞でFbxw7というユビキチンをつける酵素が高発現していることが分かりました。
私たちはこの酵素がc-Mycを分解することを世界に先駆けて報告しました。c-Mycは細胞増殖のアクセル分子であるため、もしがん幹細胞のFbxw7を壊せばc-Mycが蓄積し、細胞増殖のアクセルが踏まれるはずです。その結果、がん幹細胞が静止期から細胞増殖期へと追い出され、抗がん剤で殺せるのではないかと考えました。つまりFbxw7を壊してがん幹細胞を細胞増殖期へと移行させれば、従来の抗がん剤でがん幹細胞をやっつけることができるようになるだろうという仮説を立てるに至りました (図2-1) 。
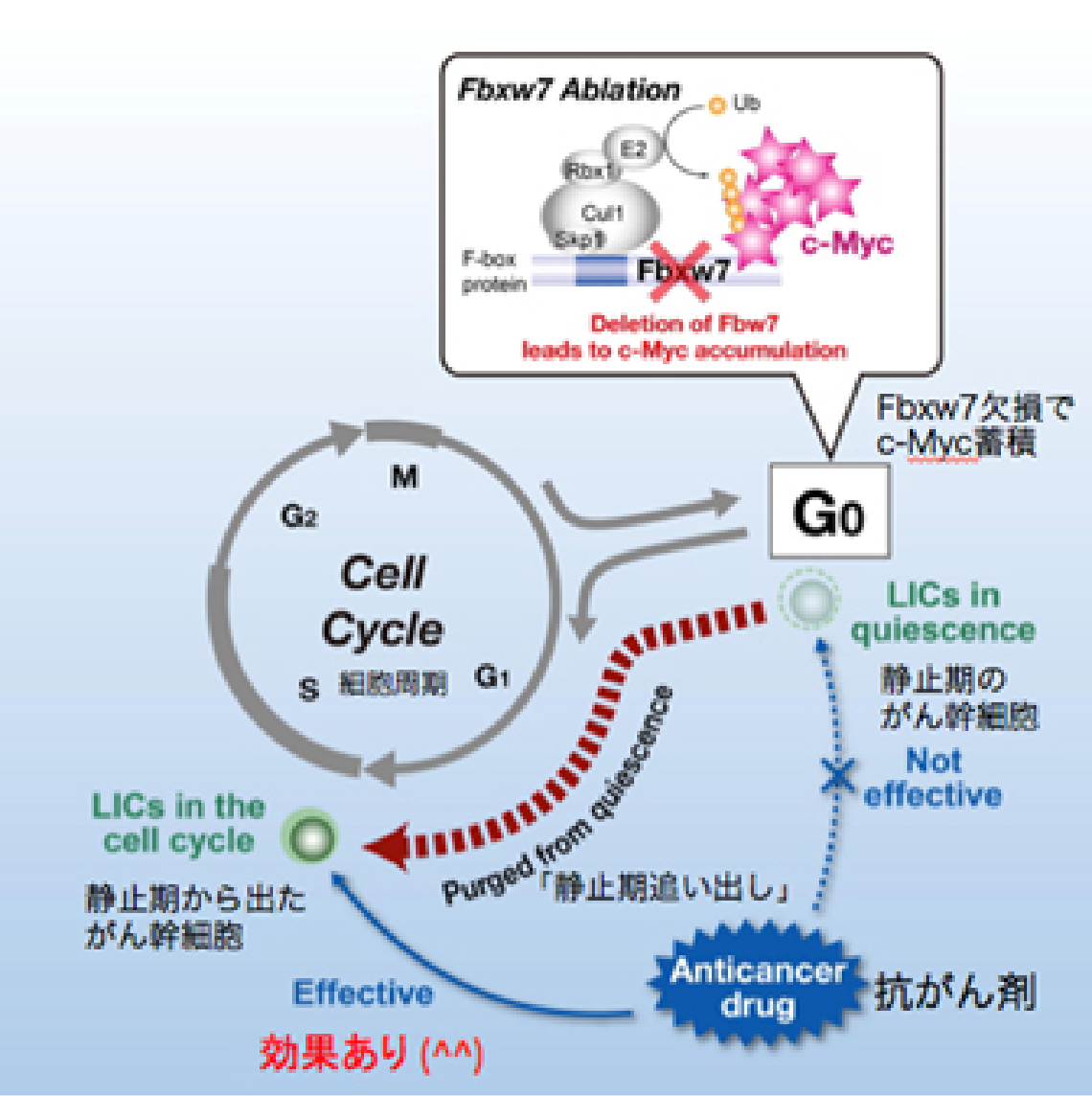
この仮説を元に、実際に実験を行ったところ、Fbxw7を欠損したがん幹細胞では予想通り静止期の割合が減少していることが判明し、さらに驚くべきことに抗がん剤治療後の生存率も著明に改善することが明らかとなりました (図2-2) 。
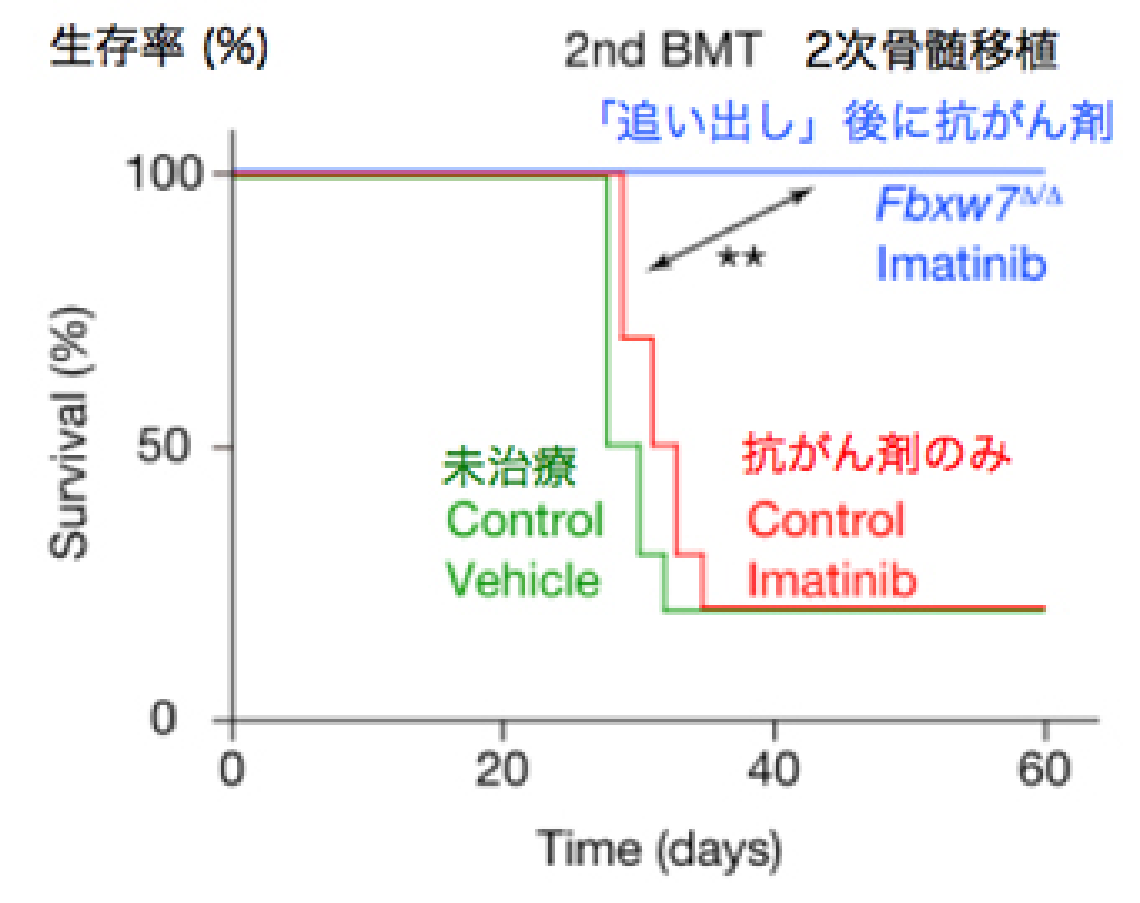
このようにして、動物モデルではFbxw7を抑制することによってがん幹細胞を根絶することに成功しましたが、いち早くヒトに対して応用するためには薬剤の開発が欠かせません。現在はFbxw7の阻害剤の開発を急ぐと同時に、他のがんでも効果があるかどうか、逆に静止期のままずっと眠らせておくことは可能なのかということも研究しています。
Research
03がん転移メカニズムの解明:実際にヒトを治療する試み
現在、日本人の2人に1人はがんにかかるといわれています。しかしがんは、なってしまえば必ず死ぬというわけではなく、外科手術や化学療法等をおこなえばある程度は治るようになってきました。一方、がんがいったん転移をしてしまえば、生存の確率は格段に低くなります。がん転移は複数の部位にわたることが多く外科手術が困難な上、既に化学療法等に耐えたがん細胞が増殖するため、これまでの治療法が効かなくなることが多いからです。このため、従来の「がん細胞を殺す」治療戦略に加え、「がん転移を抑制する」戦略が考えられ始めています。
がん細胞が生存・転移するためには、がん細胞自身の能力に加え、がん細胞の周りの正常細胞(がんニッチ細胞)の手助けが必要であることがわかってきました。がん細胞は自身の成長に有利な「お助け細胞」を呼び寄せたり、周りにいる正常細胞を“教育”して「お助け細胞」に変えてしまいます。また自分の周りだけではなく、これから転移する行先さえも居心地がいいように遠隔操作してしまいます。逆に言えば、これらのがんニッチ細胞からの手助けを断ち切ってしまえば、がん細胞は増殖や転移をしにくくなると考えられます。
われわれは最近がんニッチ細胞中のFbxw7というタンパク質ががん抑制機能、とりわけがん転移を抑制する機能を持っていることを見出しました。Fbxw7が体質的に低い人は高い人に比べてがんが再発しやすく、実験的にがんニッチ細胞でFbxw7を欠損させると「がん転移お助け細胞」になることがわかりました。この「Fbxw7欠損お助け細胞」はCCL2と呼ばれるサイトカイン*1を多く分泌してがん細胞の転移を促進していました。われわれはCCL2の機能を抑制すればがん転移は抑制できると考え、「プロパゲルマニウム」というCCL2機能抑制をもつ薬を用いたところ、マウスの系でがん転移を強力に抑制することがわかりました。
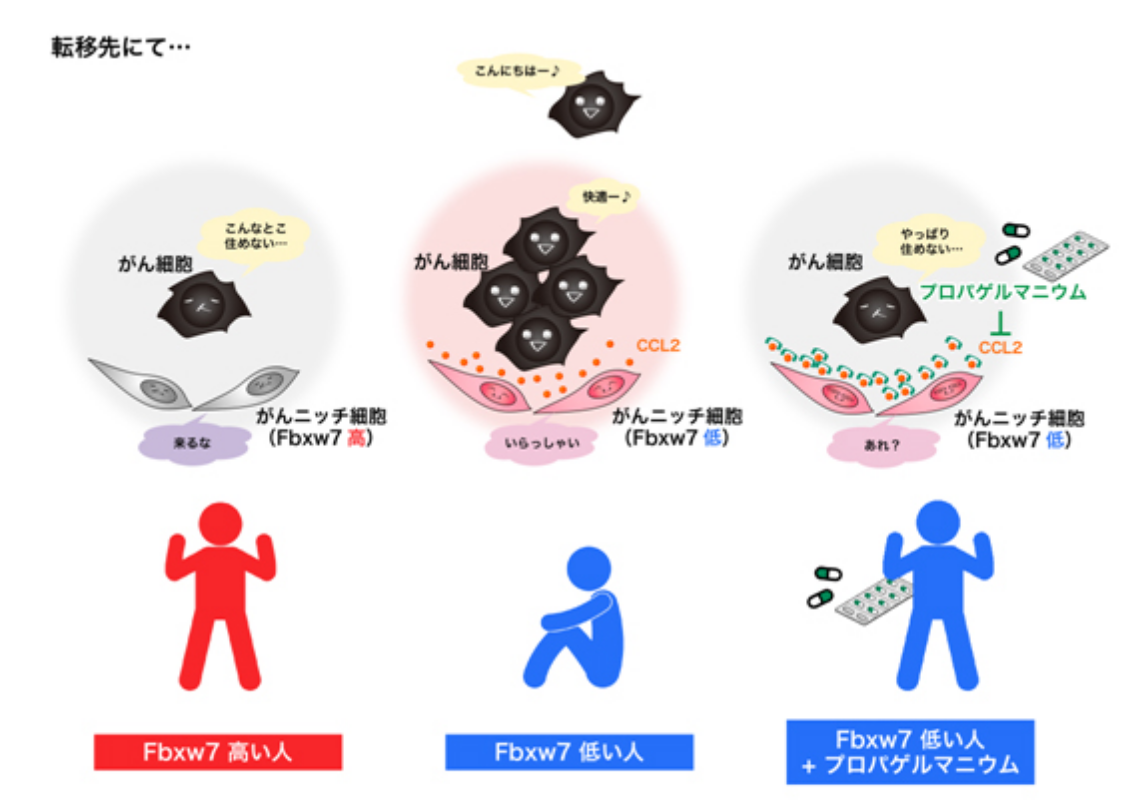
プロパゲルマニウムはB型肝炎治療薬として20年近く使用されてきた既存薬であり、ドラックリポジショニング*2の好例となることが期待されます。本薬は、既に様々な施設との共同研究により各種がん患者に対して治験を始めており、同時に、どのようながんにどのように効くか、さらなる検証実験を進めています。本研究により「がん」が「死なない病気」になることを期待しています。
*1 サイトカイン:細胞から放出され、様々な細胞間相互作用を媒介するタンパク質(液性因子)の総称
*2 ドラックリポジショニング:ある疾患に有効な治療薬から、別の疾患に有効な新たな薬効を見つけ出すこと
Research
04自閉症研究:コミュニケーションを科学する
みなさんの周りにちょっと変わった人、不思議ちゃん、KYなどと呼ばれている人がいませんか?そのような人たちの中に、自閉症スペクトラムと呼ばれる先天性のコミュニケーション障害を抱えている人がいることをご存知でしょうか。自閉症は、全人口の約2%が罹患する非常に頻度の高い疾患であり、医学的のみならず社会的に大きな問題となっています。自閉症の本質はコミュニケーション障害および常同・反復的な興味・行動を示す発達障害であり、その発症メカニズムの解明と治療法の開発が強く求められています。
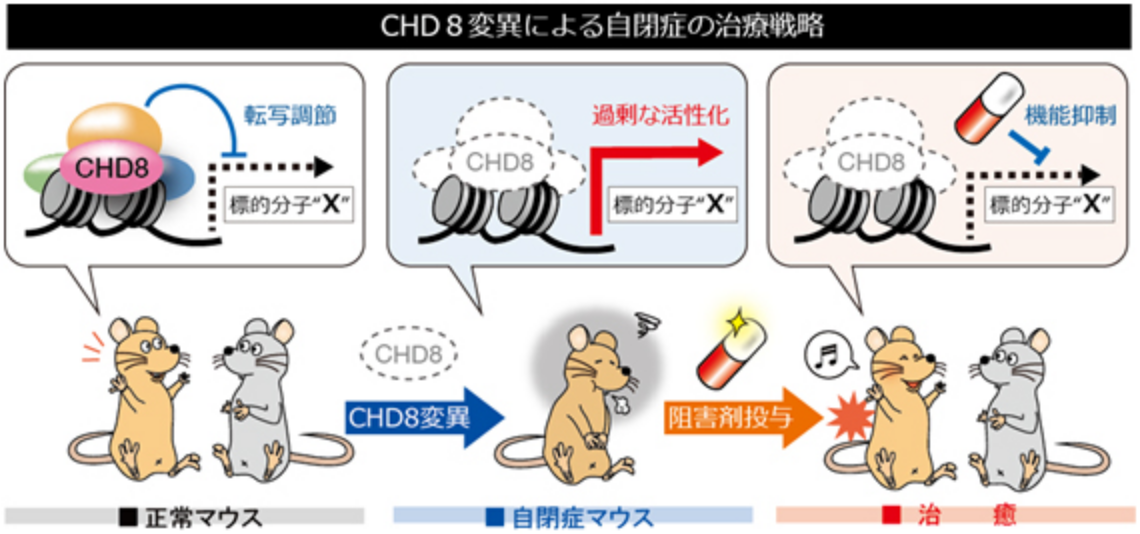
自閉症は親の育て方が悪いなどの環境要因が原因だと思っている人がいるかもしれません。しかし、実際には自閉症の発症には遺伝的要因が強く関わっていることが分かっています。例えば、同じゲノムを持つ一卵性双生児では自閉症発症の一致率が90%程度である一方で、二卵性双生児では一致率が数%程度であることが報告されています。近年、自閉症患者の大規模なゲノム解析によって、私たちのグループが今まで長年にわたって研究してきた「CHD8」という遺伝子が最も有力な自閉症原因候補遺伝子として同定され、世界中で大きな反響を呼んでいます。

CHD8はATP依存性クロマチンリモデリング因子のSNF2スーパーファミリーに属し、クロマチン構造を変化させることによって転写を調節する分子であると考えられています。CHD8(Duplin)はもともとWnt–βカテニンシグナル伝達経路の負の制御因子として同定されましたが、私たちは世界で初めてCHD8ノックアウトマウスを作製し、これらのマウスが発生初期にアポトーシスの異常な亢進により死亡することを見出しました。さらにこれまでにCHD8がp53やβカテニンの転写活性を抑制することで発生期の器官形成に重要な役割を果たしていることを示してきました。
最近、ヒト自閉症患者で報告されたCHD8変異を再現したマウスを作製し行動解析を行ったところ、自閉症を特徴付ける行動異常である社会的行動の異常や不安様行動の増加が観察されました。さらに遺伝子発現解析によって神経発生の重要な制御因子が異常活性化しており、ヒトでの知見と同様に神経発生遅延が起こることを実証しました。私たちは、これまでに作製した種々のCHD8機能喪失型マウス(ノックアウトマウス)とCHD8機能獲得型マウス(トランスジェニックマウス)を組み合わせることによって自閉症の発症時期、責任部位、責任細胞種を特定すると共に、自閉症の発症メカニズムを解明し、これらのモデルマウスを用いて新しい疾患治療法の確立を目指しています。
Research
05プロテオーム研究:生命の設計図を描く
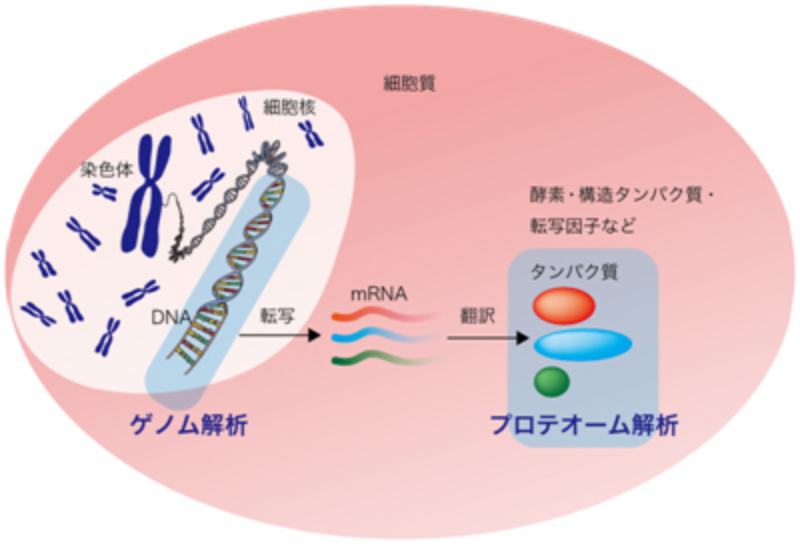
われわれが代々受け継いできた遺伝情報(その全体をゲノムと呼ぶ)は染色体上に四種類の塩基(AGCT)の配列としてコードされています。ゲノム配列情報の解析は生命の設計図を得ることに等しいと考えられ、世界中でゲノム解読プロジェクトが進行し、2000年代前半にはヒトや主要なモデル生物種のゲノム配列の解読が完了しました。しかしながら、解読されたゲノム配列は生命を構成する部品リストであり、生命の設計図とは程遠いものでした。
生命を理解するためにはこれらの部品がどのように組み合わさり、システムを構成しているかを知る必要があります。ほとんどの遺伝子は転写、翻訳されてタンパク質となりその機能を発揮します。つまりゲノムはプロテオーム(ゲノムから発現するタンパク質の総体)に変換され細胞システムを構築しているわけです。個々の細胞において各々の遺伝子は常に一定であるのに対して、タンパク質は極めて広い存在量幅(ヒトの細胞では10の6乗以上と言われている)を持っており、その状態は状況に応じて刻一刻と変わります。したがって、生命の設計図を描くには、タンパク質の発現量や機能を定量的に計測し、プロテオームが織りなす分子ネットワークの構造や機能を知ることが重要です。
プロテオームを研究する学問領域である”プロテオミクス”では、主に質量分析計と呼ばれる機器を用います。私たちの研究室では15台の質量分析計を駆使してプロテオミクスに関する技術開発を行ってきました。

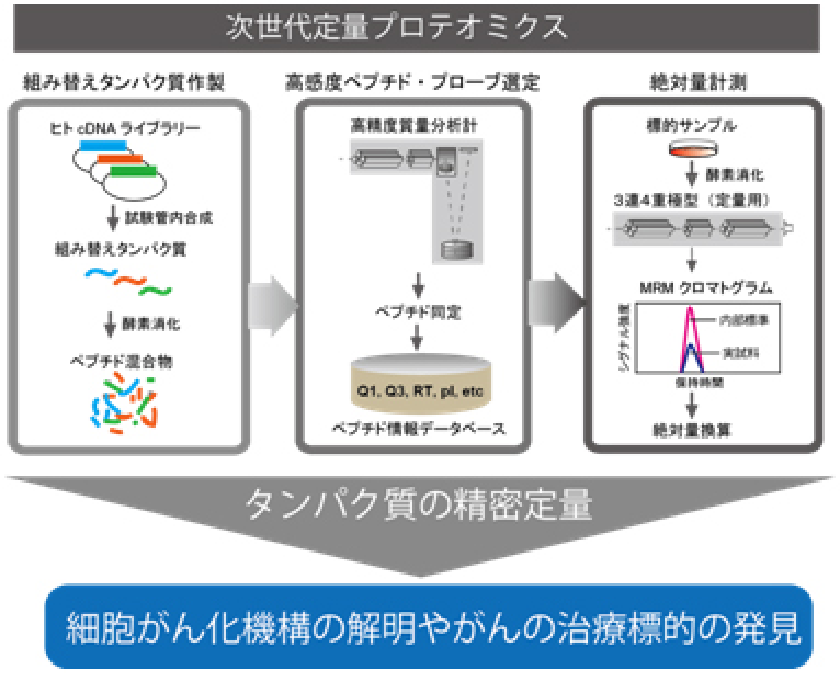
最近では、次世代の定量プロテオーム解析技術iMPAQT (in vitro proteome–assisted MRM for protein absolute quantification)法を開発し(日米英で特許取得済み)、様々な生物学や医学の研究に利用しています。
iMPAQT法では網羅的な組み替えタンパク質ライブラリーを利用して定量プロテオミクスの手法であるMRM(multiple reaction monitoring)を大規模に実施し、正確なタンパク質の絶対量を計測することが可能です。また、タンパク質の機能制御に重要なリン酸化やユビキチン化などの翻訳後修飾羅的に解析する技術も確立しており、これらを統合的に用いれば細胞の状態を規定するタンパク質情報を多面的かつ定量的に得ることが可能です。得られたタンパク質精密計測データを数理・統計学的手法で解析し、細胞システムの動作原理の解明に挑んでいます。例えば、細胞がん化やがん悪性進展過程のプロテオーム解析から、がん細胞に特有な分子ネットワークの同定を行い、これらを対象とした新たながん治療戦略の確立を目指しています。